再生医療等製品の開発において、遺伝子導入技術の選定はプロジェクトの成否を分かつ極めて重要なマイルストーンです。ウイルスベクターの高い導入効率に頼るべきか、あるいは安全性と製造コストに優れた非ウイルスベクターを選択すべきか、多くの研究開発担当者が頭を悩ませていることでしょう。本記事では、各技術の特性やメリット・デメリットを詳細に比較し、臨床応用と商用生産を見据えた最適な選択肢を導き出すための判断材料を体系的に解説いたします。
遺伝子導入技術選定の結論:目的細胞と臨床応用を見据えた最適解の導き方

遺伝子導入技術の選定は、単に実験室レベルでの効率を追求するだけでなく、将来的な臨床応用や製造プロセス(CMC)までを見通した戦略的な判断が求められます。ここでは、目的とする細胞や治療戦略に応じた技術選定の基本的な考え方について、その最適解への道筋を紐解いていきましょう。
ウイルスベクターと非ウイルスベクターの決定的な違いとは
ウイルスベクターと非ウイルスベクターの最も根本的な違いは、遺伝子導入のメカニズムにあります。ウイルスベクターは、ウイルスが本来持っている「細胞に感染して自身の遺伝子を送り込む能力」を巧みに利用するため、非常に高い導入効率を誇ります。
一方で、非ウイルスベクターは、脂質やポリマーを用いた化学的な手法や、電気パルスなどの物理的な手法によって遺伝子を細胞内に導入します。こちらはウイルス由来の成分を含まないため、安全性や免疫原性の面で有利であり、製造コストも比較的抑えやすいという特徴があります。開発品目の特性に合わせて、この「生物学的機構」と「物理化学的機構」のどちらを採用すべきかを見極めることが第一歩となります。
ターゲット細胞と導入効率から見る技術選定のフローチャート
最適な技術を選定するためには、ターゲット細胞の特性と求められる導入効率を軸にしたフローチャートを描くことが有効です。まず、対象となる細胞が「分裂細胞」か「非分裂細胞」かを確認しましょう。非分裂細胞であれば、レンチウイルスやAAV、あるいは非ウイルス法が候補に挙がります。
次に、In vivo(生体内)投与かEx vivo(生体外)投与かを考慮します。In vivoであれば組織指向性のあるAAVやLNP(脂質ナノ粒子)が、Ex vivoであれば導入効率の高いレンチウイルスやエレクトロポレーションが適している場合が多いです。このように、細胞の生理学的特性と投与経路を掛け合わせることで、候補となる技術を絞り込んでいくことが可能です。
臨床開発ステージにおけるコストと安全性のトレードオフ
研究開発の初期段階では導入効率が最優先されがちですが、臨床開発ステージが進むにつれて「コスト」と「安全性」の重要度が増していきます。ウイルスベクターは製造プロセスが複雑で、GMP準拠の製造には莫大なコストと時間を要します。
対して非ウイルスベクターは、化学合成が可能であるためスケールアップが容易で、製造コストを大幅に削減できる可能性があります。しかし、導入効率が不十分であれば治療効果が得られません。したがって、Phase I/IIの段階から将来の商用生産を見据え、許容できるコスト範囲と必要な安全性プロファイルのバランス(トレードオフ)を慎重に検討し、技術変更のリスクを最小限に抑える計画が必要です。
ウイルスベクターの特性と主要4種の技術的詳細
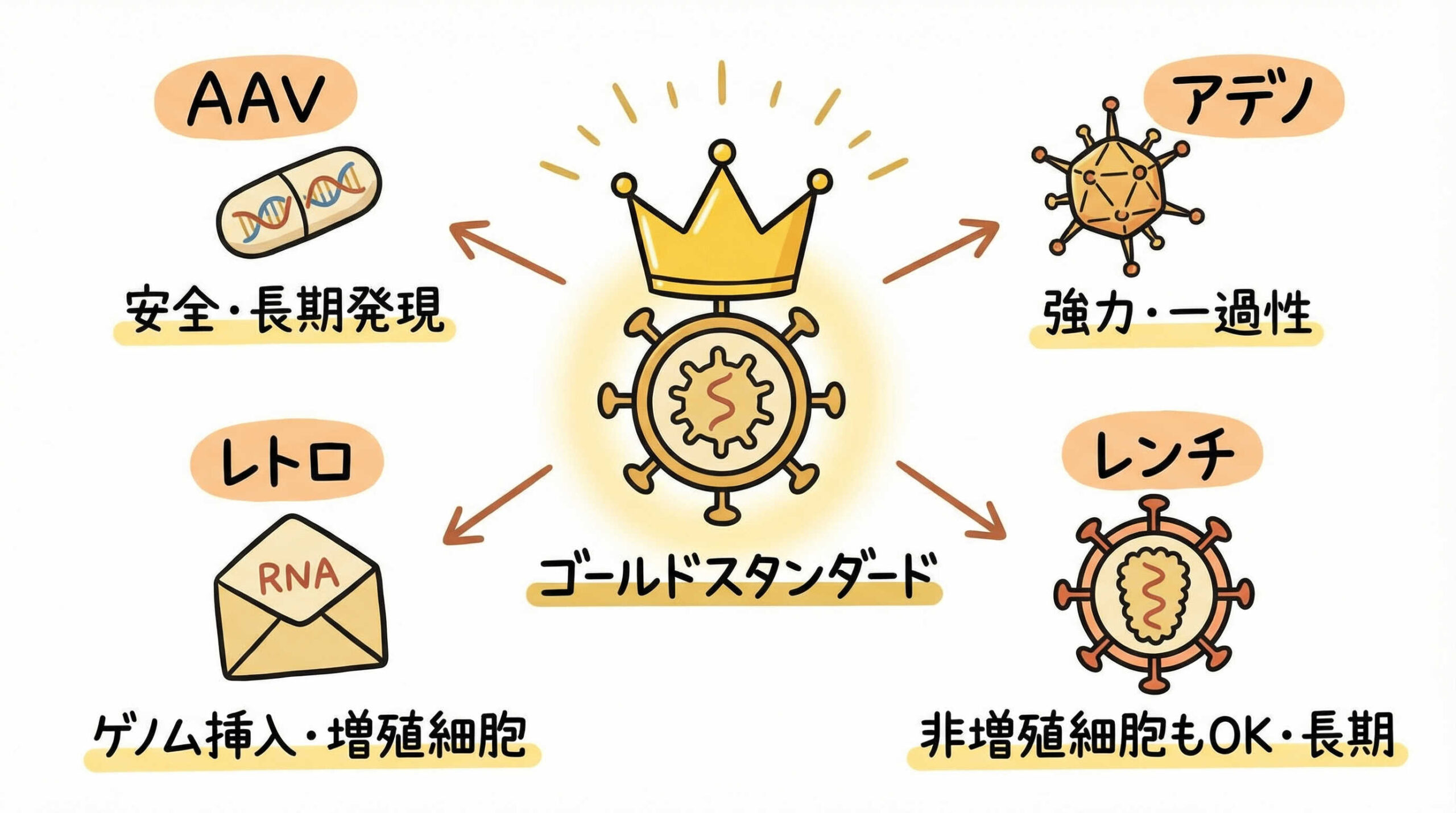
現在、多くの遺伝子治療や細胞治療製品で採用されているウイルスベクターは、その高い導入効率から「ゴールドスタンダード」としての地位を確立しています。ここでは、主要な4種類のウイルスベクターについて、それぞれの技術的特性や適した用途について詳しく見ていきましょう。
アデノ随伴ウイルス(AAV)ベクター:安全性と組織指向性の高さ
アデノ随伴ウイルス(AAV)ベクターは、病原性が極めて低く、分裂・非分裂細胞の両方に遺伝子導入が可能であることから、近年特にIn vivo遺伝子治療で注目されています。最大の特徴は、多様な血清型(セロタイプ)を使い分けることで、特定の臓器や組織への指向性を持たせられる点です。
また、宿主ゲノムへの組込みリスクが低く、エピソームとして存在するため、安全性が比較的高いとされています。ただし、搭載できる遺伝子サイズが約4.7kbと小さいため、大型の遺伝子を導入する際には設計上の工夫が必要となります。
レンチウイルスベクター:非分裂細胞への導入と長期安定発現
レンチウイルスベクターは、HIV(ヒト免疫不全ウイルス)を基に開発されたベクターであり、分裂細胞だけでなく非分裂細胞にも効率よく遺伝子を導入できる点が大きな強みです。宿主ゲノムに遺伝子を組み込む性質を持つため、細胞分裂を経ても導入遺伝子が娘細胞に受け継がれ、長期的な安定発現が期待できます。
この特性から、CAR-T療法などのEx vivo遺伝子治療において標準的に利用されています。安全性に関しては、自己複製能を欠損させるなどの改良が重ねられており、臨床使用における実績も豊富に蓄積されています。
レトロウイルスベクター:分裂細胞への組込みと豊富な臨床実績
レトロウイルスベクターは、最も古くから臨床応用されているベクターの一つであり、主に分裂細胞に対して高い導入効率を示します。レンチウイルスと同様に宿主ゲノムへの組込みが起こるため、恒久的な遺伝子発現が可能です。
数多くの臨床試験で使用されてきた豊富な実績があり、製造プロセスや品質管理の手法も確立されています。しかし、非分裂細胞への導入が困難であることや、ゲノム挿入位置によってはがん化リスク(挿入変異)の懸念があるため、近年ではより安全性の高いレンチウイルスへの移行が進んでいる領域もあります。
アデノウイルスベクター:一過性の高発現と大きな搭載容量
アデノウイルスベクターは、非常に高い導入効率と、約36kbという大きな遺伝子搭載容量を持つことが特徴です。感染しても宿主ゲノムには組み込まれず、一過性の強力な発現を示します。
このため、遺伝子ワクチンやがん治療用ウイルスなど、短期間で高いタンパク質発現が求められる用途に適しています。一方で、人体がアデノウイルスに対する既存免疫を持っている場合が多く、強い免疫反応を引き起こすリスクがあるため、全身投与には慎重な検討が必要です。
ウイルスベクター使用時の主な懸念点(免疫原性と挿入変異)
ウイルスベクターを使用する際に避けて通れないのが、免疫原性と挿入変異のリスクです。ウイルスは外来異物として認識されるため、生体内で中和抗体が産生されたり、細胞性免疫応答によって排除されたりする可能性があります。これが治療効果の減弱や副作用の原因となります。
また、レトロウイルスやレンチウイルスのようにゲノムに組み込まれるタイプでは、がん抑制遺伝子などを破壊したり、がん原遺伝子を活性化させたりする「挿入変異」のリスクが理論上存在します。これらの懸念に対し、ベクターの改良や投与プロトコルの最適化が進められています。
非ウイルスベクターの特性と主要手法の技術的詳細
安全性への配慮や製造コストの削減を目指し、ウイルスを使わない「非ウイルスベクター」の技術開発が急速に進展しています。COVID-19ワクチンでの成功を契機に注目を集めるLNPをはじめ、主要な非ウイルス導入技術の特性について解説します。
脂質ナノ粒子(LNP):低免疫原性とドラッグデリバリーシステム(DDS)の応用
脂質ナノ粒子(LNP)は、mRNAワクチンでの成功により一躍脚光を浴びた技術です。正電荷を持つ脂質が負電荷の核酸を包み込み、細胞内への送達を助けます。ウイルスベクターと比較して免疫原性が低く、反復投与が可能である点が大きなメリットです。
また、肝臓への集積性が高いという特性があり、肝疾患を対象とした治療薬開発に適しています。現在では、肝臓以外の組織へ送達するための脂質組成の改良など、ドラッグデリバリーシステム(DDS)としての高度な応用研究が活発に行われています。
リポフェクション法:試薬の汎用性とスクリーニング段階での利便性
リポフェクション法は、陽イオン性脂質を用いて核酸と複合体を形成し、エンドサイトーシスによって細胞内に取り込ませる手法です。操作が簡便であり、多種多様な試薬が市販されているため、基礎研究やスクリーニング段階で広く利用されています。
特別な機器を必要とせず、手軽に導入実験を行える利便性が魅力ですが、臨床応用においては導入効率や細胞毒性の面で課題が残る場合もあります。それでも、初期検討におけるコストパフォーマンスの良さは、開発のスピードアップに貢献するでしょう。
エレクトロポレーション(電気穿孔法):物理的導入による高い導入効率
エレクトロポレーション(電気穿孔法)は、細胞に短い電気パルスを与えることで細胞膜に一時的な穴を開け、そこから遺伝子を導入する物理的な手法です。ウイルスベクターや化学的手法では導入が難しい細胞に対しても、高い効率で導入できるのが特徴です。
プラスミドDNAだけでなく、mRNAやタンパク質そのものを導入することも可能です。ただし、電気刺激による細胞へのダメージ(細胞死)が避けられないため、条件検討による生存率と導入効率のバランス調整が重要になります。近年では、細胞への負担を軽減した高性能な装置も開発されています。
高分子ポリマー・ミセル:化学修飾による機能付与と設計の自由度
高分子ポリマーやミセルを用いた導入法は、化学合成によって分子設計を自由に行える点が最大の強みです。ポリエチレンイミン(PEI)などが代表的ですが、分子量や構造を調整したり、特定の細胞に結合するリガンドを修飾したりすることで、機能性を付与することができます。
ウイルスのようなサイズ制限が少なく、大量生産時の品質均一性も確保しやすいというCMC上の利点があります。生分解性ポリマーを使用することで、細胞毒性を低減させる試みも進んでおり、次世代のDDSとして期待されています。
非ウイルスベクター使用時の主な懸念点(細胞毒性と導入効率の限界)
非ウイルスベクターの最大の課題は、一般的にウイルスベクターと比較して導入効率が低いことです。特にIn vivoでの全身投与においては、標的組織に到達する前に分解されたり、排出されたりすることがあります。
また、導入効率を上げようとして試薬の濃度や電気パルスの強度を高めると、細胞毒性が顕著に現れ、細胞の生存率や機能に悪影響を及ぼすリスクがあります。「高い導入効率」と「低い細胞毒性」の両立は、非ウイルス技術開発における永遠のテーマであり、現在も多くの研究者が改良に取り組んでいます。
【項目別比較】ウイルスベクター対非ウイルスベクターの優位性評価

最適なベクターを選定するためには、各技術のメリット・デメリットを多角的な視点から比較検討することが不可欠です。ここでは、効率、容量、安全性、製造プロセス、コストという5つの重要項目に焦点を当て、ウイルスベクターと非ウイルスベクターの優位性を比較評価します。
遺伝子導入効率と発現期間における比較
遺伝子導入効率に関しては、現時点ではウイルスベクターに軍配が上がります。特にIn vivoでの組織への送達や、難導入性細胞への導入においては、ウイルスの感染機構が圧倒的な強みを発揮します。また、レンチウイルスなどを用いれば、長期間にわたる安定した発現も期待できます。
一方、非ウイルスベクターは導入効率で劣る場合が多いものの、LNPやエレクトロポレーションの技術革新により、その差は徐々に縮まりつつあります。発現期間については、非ウイルス法では一過性発現となることが一般的ですが、ゲノム編集技術との組み合わせで恒久発現を狙うアプローチも登場しています。
搭載可能な遺伝子サイズ(パッケージング容量)の比較
搭載可能な遺伝子のサイズ(パッケージング容量)については、非ウイルスベクターが圧倒的に有利です。AAVでは約4.7kb、レンチウイルスでも約10kbという制限がありますが、LNPやポリマーなどの非ウイルスベクターには、理論上厳しいサイズ制限がありません。
このため、ジストロフィン遺伝子のような巨大な遺伝子や、複数の遺伝子を同時に導入する必要がある場合には、非ウイルスベクターが第一選択肢となり得ます。また、プラスミドDNAやmRNAなど、導入する核酸の形態を選ばない点も非ウイルス法の大きなメリットでしょう。
安全性プロファイル(がん化リスク・免疫応答)の比較
安全性プロファイルにおいては、非ウイルスベクターが優位性を持ちます。ウイルス由来のタンパク質を含まないため、免疫応答のリスクが低く、反復投与が容易です。また、基本的にゲノムへの組込みを行わないため、がん化のリスクも極めて低いと言えます。
対してウイルスベクターは、免疫原性による炎症反応や中和抗体の産生、そして挿入変異による腫瘍形成リスクが常に懸念事項となります。特にAAVの高用量投与では重篤な副作用が報告された例もあり、安全性マージンの確保には慎重な設計が求められます。
製造プロセス(CMC)の複雑さとスケーラビリティの比較
製造プロセス(CMC)の観点からは、非ウイルスベクターの方がスケーラビリティに優れています。化学合成プロセスが主であるため、反応の制御がしやすく、スケールアップ時の品質の一貫性を保ちやすい傾向にあります。
一方、ウイルスベクターの製造は、細胞培養を用いた生物学的プロセスに依存するため、複雑で繊細な制御が必要です。培養スケールを上げる際の条件検討が難しく、不純物の除去やウイルスの濃縮・精製工程において技術的なハードルが高くなります。これが製造キャパシティの不足や、開発スケジュールの遅延につながることも少なくありません。
製造コストと品質管理(QC)の難易度比較
製造コストと品質管理(QC)においても、非ウイルスベクターに利があります。製造工程が比較的シンプルであるため、製造原価を抑えやすく、品質試験の項目も化学物質としての評価が中心となるため明確化しやすいです。
対してウイルスベクターは、GMP製造にかかるコストが非常に高く、数億円規模になることも珍しくありません。また、感染性力価の測定や複製可能ウイルス(RCR)の否定試験など、生物学的製剤特有の複雑で時間のかかる品質試験が求められます。このコストと手間の差は、製品の薬価や普及スピードに直結する重要な要素です。
再生医療等製品の開発における技術選定の重要ポイント
技術的なスペック比較だけでなく、実際の製品開発プロセスにおいては、規制対応やサプライチェーンの構築など、ビジネス面や実務面での考慮も欠かせません。再生医療等製品の開発を成功に導くために押さえておくべき、技術選定の重要ポイントを整理します。
Ex vivo遺伝子治療とIn vivo遺伝子治療による選択基準の違い
Ex vivo(体外)遺伝子治療とIn vivo(体内)遺伝子治療では、求められるベクターの要件が異なります。Ex vivoでは、細胞を体外に取り出して操作するため、エレクトロポレーションやレンチウイルスを用いて、高い効率で確実に遺伝子を導入することが重視されます。免疫原性の影響も比較的受けにくい環境です。
一方、In vivoではベクターを直接患者に投与するため、標的組織への指向性(トロピズム)と安全性が最優先されます。AAVやLNPが選ばれることが多いのはこのためです。開発品目がどちらのアプローチを採るかによって、選択肢は自ずと絞られてくるでしょう。
規制要件(カルタヘナ法・GMP)への対応と承認ハードル
遺伝子導入技術を選定する際は、カルタヘナ法(遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律)やGMP(医薬品の製造管理及び品質管理の基準)への対応を早期から考慮する必要があります。
特にウイルスベクターを使用する場合、カルタヘナ法に基づく第一種使用等の承認申請が必要となり、環境への拡散防止措置などが求められます。また、GMP製造においては、ウイルス除去や無菌性の保証など、高いレベルの管理体制が必須です。これらの規制ハードルをクリアできる技術であるか、またそのためのデータ取得が可能かを事前に精査することが肝要です。
CDMO委託を見据えた製造プロセスの確立と技術移転の容易さ
多くのバイオベンチャーや製薬企業にとって、自社ですべての製造を行うことは困難であり、CDMO(医薬品開発製造受託機関)への委託が一般的です。そのため、選定した技術がCDMOに移転しやすいものであるかどうかも重要な視点です。
特殊すぎる技術や独自すぎるプロセスは、受託可能なCDMOが限られ、製造枠の確保が難航するリスクがあります。汎用的なプラットフォーム技術を採用することで、技術移転をスムーズに進め、安定した供給体制を構築することが可能になります。CDMOの実績や保有技術と照らし合わせながら選定を進めることが賢明です。
次世代技術の動向:改良型カプシドとハイブリッドベクターの可能性
遺伝子導入技術は日進月歩で進化しています。ウイルスベクターでは、指向性を高め免疫原性を下げた「改良型カプシド」の開発が進み、非ウイルスベクターでは組織指向性を持つLNPが登場しています。
さらに、ウイルスと非ウイルスの長所を組み合わせた「ハイブリッドベクター」の研究も行われています。現時点での最適解だけでなく、数年後の承認申請時を見据え、こうした次世代技術の動向にもアンテナを張っておくことが、競争力のある製品開発につながります。最新の論文や学会情報から、技術の将来性を予測することも大切です。
まとめ
遺伝子導入技術の選定は、再生医療等製品の開発において最もクリティカルな意思決定の一つです。ウイルスベクターの高い導入効率と実績、非ウイルスベクターの安全性とコストメリット、それぞれの特性を深く理解し、開発品目のターゲット細胞、治療戦略、そして将来の商用化プランに合致した技術を選ぶ必要があります。
単一の正解は存在しません。効率、安全性、コスト、規制対応のバランスを慎重に見極め、必要であれば専門家やCDMOの知見も借りながら、自社のプロジェクトにとっての「最適解」を導き出してください。その戦略的な選択こそが、革新的な治療法を患者さんの元へ届けるための第一歩となるでしょう。
遺伝子導入技術(ウイルスベクター/非ウイルス)の比較についてよくある質問
の比較についてよくある質問-scaled.jpg)
遺伝子導入技術の比較検討において、研究開発の現場からよく寄せられる質問とその回答をまとめました。技術選定の際の参考にしてください。
- Q1. AAVベクターとレンチウイルスベクターの主な使い分け基準は何ですか?
- A1. 基本的に、In vivo(体内投与)の場合は組織指向性のあるAAV、Ex vivo(体外での細胞加工)の場合は導入効率が高くゲノムに組み込まれるレンチウイルスが選ばれる傾向にあります。ターゲット細胞が分裂細胞かどうかも判断基準になります。
- Q2. 非ウイルスベクターを臨床応用する際の最大の課題は何ですか?
- A2. 多くのケースで、ウイルスベクターに比べて「遺伝子導入効率が低い」ことが最大の課題です。また、効率を上げようとすると細胞毒性が高まる傾向があり、このバランスをどう取るかが開発の鍵となります。
- Q3. 製造コスト(CoG)を抑えるためにはどちらのベクターが有利ですか?
- A3. 一般的には非ウイルスベクターの方が有利です。化学合成が可能でスケールアップしやすく、品質管理も比較的シンプルだからです。ウイルスベクターは培養・精製工程が複雑で、GMP製造コストが高額になりがちです。
- Q4. カルタヘナ法への対応が必要なのはどのような場合ですか?
- A4. ウイルスベクターなどの「遺伝子組換え生物等」を使用する場合に必要です。製造工程(第二種使用等)だけでなく、患者への投与(第一種使用等)においても、環境への拡散防止措置などについて承認を得る必要があります。
- Q5. 将来的にウイルスベクターは非ウイルスベクターに置き換わりますか?
- A5. 完全な置き換えは考えにくいでしょう。非ウイルス技術は進化していますが、ウイルスの持つ感染能力の高さは依然として強力です。用途に応じて両者が共存し、使い分けられていく未来が予想されます。
<script type="application/ld+json">
{
"@context": "https://schema.org",
"@type": "FAQPage",
"mainEntity": [
{
"@type": "Question",
"name": "AAVベクターとレンチウイルスベクターの主な使い分け基準は何ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "基本的に、In vivo(体内投与)の場合は組織指向性のあるAAV、Ex vivo(体外での細胞加工)の場合は導入効率が高くゲノムに組み込まれるレンチウイルスが選ばれる傾向にあります。ターゲット細胞が分裂細胞かどうかも判断基準になります。"
}
},
{
"@type": "Question",
"name": "非ウイルスベクターを臨床応用する際の最大の課題は何ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "多くのケースで、ウイルスベクターに比べて「遺伝子導入効率が低い」ことが最大の課題です。また、効率を上げようとすると細胞毒性が高まる傾向があり、このバランスをどう取るかが開発の鍵となります。"
}
},
{
"@type": "Question",
"name": "製造コスト(CoG)を抑えるためにはどちらのベクターが有利ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "一般的には非ウイルスベクターの方が有利です。化学合成が可能でスケールアップしやすく、品質管理も比較的シンプルだからです。ウイルスベクターは培養・精製工程が複雑で、GMP製造コストが高額になりがちです。"
}
},
{
"@type": "Question",
"name": "カルタヘナ法への対応が必要なのはどのような場合ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "ウイルスベクターなどの「遺伝子組換え生物等」を使用する場合に必要です。製造工程(第二種使用等)だけでなく、患者への投与(第一種使用等)においても、環境への拡散防止措置などについて承認を得る必要があります。"
}
},
{
"@type": "Question",
"name": "将来的にウイルスベクターは非ウイルスベクターに置き換わりますか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "完全な置き換えは考えにくいでしょう。非ウイルス技術は進化していますが、ウイルスの持つ感染能力の高さは依然として強力です。用途に応じて両者が共存し、使い分けられていく未来が予想されます。"
}
}
]
}
</script>



