画期的な基礎研究の成果が生まれたとしても、それを実際の患者様へ届けるまでの道のりは決して平坦ではありません。特に再生医療分野においては、科学的な発見を臨床応用へと橋渡しする「トランスレーショナルリサーチ(TR)」のプロセスが極めて複雑であり、多くのシーズが「死の谷」を越えられずに停滞してしまうのが現状です。
「素晴らしい技術なのに、なぜ臨床試験に進めないのか」「規制の壁をどう乗り越えればよいのか」とお悩みの方も多いのではないでしょうか。
本記事では、再生医療シーズの実用化を目指す研究開発担当者やプロジェクトマネージャーの方々に向けて、トランスレーショナルリサーチの具体的な進め方を解説します。出口戦略(TPP)からの逆算思考に基づき、規制要件を見据えたロードマップの策定からPMDA相談の活用法まで、実務に即したポイントを整理しました。確実な臨床入りを目指すための一助としてお役立てください。
トランスレーショナルリサーチ(TR)の進め方の結論は「出口戦略(TPP)からの逆算」
の進め方の結論は「出口戦略(TPP)からの逆算」-scaled.jpg)
トランスレーショナルリサーチ(TR)を成功に導くための最大の秘訣は、開発の初期段階から最終的なゴールを明確に見据えることです。闇雲に実験を進めるのではなく、「どのような製品として世に出したいか」という出口戦略から逆算して、必要なデータを積み上げていくアプローチが不可欠です。ここでは、その核となる考え方について解説します。
ターゲット・プロダクト・プロファイル(TPP)の策定が最優先
トランスレーショナルリサーチを進める上で、まず最初に取り組むべきは「ターゲット・プロダクト・プロファイル(TPP)」の策定です。TPPとは、開発しようとする製品のプロファイル(適応症、用法・用量、効能・効果、安全性など)を目標として設定した文書のことで、いわば「将来の添付文書のドラフト」といえます。
TPPを早期に作成することで、開発チーム全体でゴールのイメージを共有できるだけでなく、そのゴールに到達するために「何が足りないか」「どのデータを取得すべきか」が明確になります。TPPは一度作って終わりではなく、開発の進展とともに随時更新し、常に羅針盤として機能させることが重要です。まずは理想的な製品像を具体的に言語化することから始めてみましょう。
規制要件を見据えた開発ロードマップの重要性
TPPで定めたゴールにたどり着くためには、規制要件(レギュレーション)を遵守した開発ロードマップの作成が欠かせません。再生医療等製品の開発では、「再生医療等安全性確保法」や「薬機法」といった関連法規への適合が求められます。
特に、非臨床試験から臨床試験(治験)へ移行する際には、規制当局(PMDA)が求める品質や安全性の基準を満たしている必要があります。どのタイミングでどのガイドラインを参照し、いつPMDA相談を行うかというマイルストーンを事前に設定しておくことで、手戻りのない効率的な開発が可能となります。規制は「障壁」ではなく「安全な製品を届けるためのルール」と捉え、戦略的に組み込んでいきましょう。
基礎研究と臨床開発のギャップを埋めるための思考法
基礎研究と臨床開発の間には、求められるデータの質や視点に大きな違いがあります。基礎研究では「新規性」や「メカニズムの解明」が重視されますが、臨床開発等のTR段階では「ヒトでの安全性」「品質の恒常性」「製造の再現性」が最優先されます。
このギャップを埋めるためには、研究者自身が「論文を書くための実験」から「承認申請資料を作るための試験」へとマインドセットを切り替える必要があります。例えば、実験室レベルの手技を、GMP(GCTP)省令に準拠した製造プロセスへと落とし込むには、工業化の視点が不可欠です。早期から薬事や製造の専門家を巻き込み、臨床応用を見据えた現実的な解を模索する思考法を持ちましょう。
再生医療におけるトランスレーショナルリサーチの重要性と課題
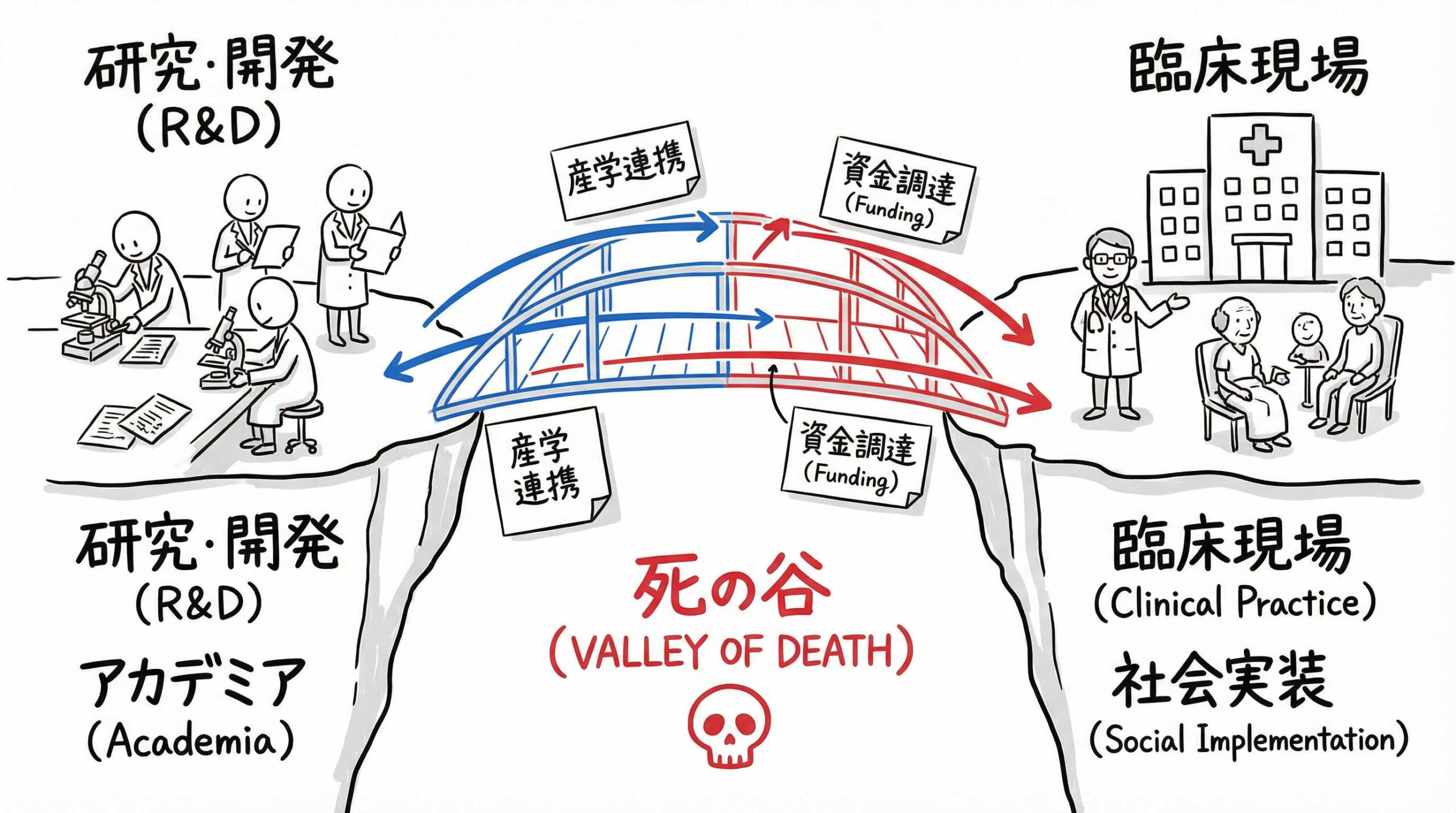
再生医療分野は技術革新が著しい一方で、有望なシーズが実用化に至らず消えていくケースも少なくありません。いわゆる「死の谷」と呼ばれる現象です。なぜ多くのプロジェクトがここで躓いてしまうのでしょうか。ここでは、再生医療におけるTRの重要性と、乗り越えるべき課題について掘り下げていきます。
「死の谷(Valley of Death)」と呼ばれる障壁の実態
「死の谷(Valley of Death)」とは、基礎研究の成果と産業化(製品化)の間にある、資金や人材、知見の不足による深い溝のことを指します。特に再生医療においては、従来の低分子医薬品とは異なる特有の難しさがあります。
例えば、生きた細胞を扱うための品質管理の難しさ、高額な製造コスト、複雑な規制対応などが挙げられます。これらの課題に対し、アカデミアの研究費だけでは対応しきれず、かといって企業が投資するにはリスクが高すぎるという状況に陥りがちです。この谷を越えるためには、TRの段階でこれらのリスクを一つひとつ潰し、企業が参入しやすい(投資判断ができる)状態までシーズを磨き上げることが求められます。
アカデミア発シーズが実用化に至らない主な要因
アカデミア発のシーズが実用化に至らない大きな要因の一つに、「再現性と堅牢性の欠如」があります。特定の熟練した研究者にしか作れない細胞や、実験ごとに結果がばらつく製造方法では、医薬品としての承認を得ることはできません。
また、研究段階で使用していた試薬や培地に、臨床で使用できない成分(動物由来成分など)が含まれていることに後から気づき、開発が振り出しに戻るケースも散見されます。さらに、ビジネスとしての採算性や市場規模の検討が不十分なまま進めてしまい、途中で開発資金が尽きてしまうこともあります。科学的な素晴らしさだけでなく、製品としての成立性を早期に検証することが不可欠です。
早期からの知財戦略と薬事戦略の必要性
TRを成功させるためには、研究初期からの「知財戦略」と「薬事戦略」の両輪が必要です。特許は、単に技術を守るだけでなく、企業との提携や資金調達において強力な武器となります。基本特許だけでなく、製造プロセスや用途特許など、網羅的な知財ポートフォリオを構築することが重要です。
同時に、薬事戦略も欠かせません。「どのようなデータがあればPMDAは治験開始を認めるか」という規制側のロジックを理解し、無駄のない試験計画を立てる必要があります。知財と薬事は後回しにされがちですが、これらが欠けていると、どんなに優れた技術でも事業化の土俵に乗ることは難しいでしょう。
再生医療シーズを臨床へ橋渡しする具体的な進め方・ロードマップ
では、実際にどのような手順でトランスレーショナルリサーチを進めていけばよいのでしょうか。ここでは、シーズの選定から治験届の提出に至るまでのプロセスを5つのステップに分解し、具体的なロードマップとして提示します。各ステップでの要点を押さえ、着実な進捗を目指しましょう。
ステップ1:医療ニーズの明確化と製品コンセプトの立案
最初のステップは、アンメット・メディカル・ニーズ(未だ満たされていない医療ニーズ)の特定と、それに対する製品コンセプトの立案です。「誰の、どんな疾患を、どのように治すのか」を明確にします。
ここでは、既存の治療法との差別化ポイントを整理することが重要です。単に「効くかもしれない」ではなく、「既存治療よりも効果が高い」「副作用が少ない」「患者のQOLが向上する」といった具体的なベネフィットを定義します。このコンセプトがブレていると、後の工程すべてに影響を及ぼすため、臨床医やマーケティング担当者とも連携し、市場性を含めて慎重に検討しましょう。
ステップ2:製造方法の確立と品質管理(CMC)の検討
製品コンセプトが固まったら、次は製造方法の確立と品質管理(CMC: Chemistry, Manufacturing and Control)の検討に入ります。研究用レベルの製造フローを、GCTP(再生医療等製品の製造管理及び品質管理の基準)に適合する形へ最適化します。
具体的には、原材料の適格性確認、製造プロセスの標準化、品質試験項目の設定などを行います。特に細胞製品の場合、ドナーによるばらつきや培養工程での変化をどう制御するかが鍵となります。臨床試験で使用する治験製品は、本番の商業生産と同等の品質で製造される必要があるため、この段階でのCMC構築は極めて重要です。
ステップ3:非臨床試験(薬理・安全性)によるPOC取得
確立した製造物を用いて、非臨床試験を実施します。これは、ヒトに投与する前の最終確認として、動物モデル等を用いて有効性(POC: Proof of Concept)と安全性を評価するステップです。
有効性試験では、想定される作用機序を裏付けるデータを取得します。一方、安全性試験では、造腫瘍性(がん化のリスク)や体内分布、毒性などを厳密に評価します。これらの試験は、可能な限りGLP(優良試験所基準)適用下、またはそれに準じた信頼性のある体制で実施する必要があります。ここで得られたデータが、治験開始の妥当性を主張する根拠となります。
ステップ4:PMDA(規制当局)との相談・合意形成
データがある程度揃った段階で、PMDA(医薬品医療機器総合機構)の対面助言制度を活用し、規制当局との合意形成を図ります。これは「自分たちの開発計画や試験結果が、規制要件を満たしているか」を確認するための重要なプロセスです。
特に「再生医療等製品事前面談」や「レギュラトリーサイエンス戦略相談」などを利用し、CMCや非臨床試験のパッケージ、そして治験プロトコルの骨子について議論します。PMDAからの指導事項を開発計画に反映させることで、後の審査での手戻りを防ぎ、スムーズな治験開始へと繋げることができます。相談は一度きりではなく、開発段階に応じて複数回行うのが一般的です。
ステップ5:治験プロトコルの作成と治験届の提出
PMDAとの相談を経て方針が固まったら、いよいよ治験実施計画書(プロトコル)の作成と治験届の提出です。プロトコルには、被験者の選択・除外基準、投与方法、評価項目、統計解析手法などを詳細に記載します。
治験届を提出すると、PMDAによる「治験届出後30日調査」が行われ、安全性や倫理面に問題がないか審査されます。この期間に照会事項があれば対応し、問題がなければ治験を開始することができます。ここまでの道のりは長いですが、このステップをクリアすることで、シーズは晴れて臨床試験という新たなステージへと進むことになります。
TR段階で確実にクリアすべき規制要件と品質基準

トランスレーショナルリサーチにおいて、科学的なデータの取得と同じくらい重要なのが、規制要件への適合です。特に再生医療等製品は、その特性上、厳格な品質管理と安全性の保証が求められます。ここでは、TR段階で確実にクリアしておくべき主要な規制基準について解説します。
GCTP省令に準拠した製造管理・品質管理体制の構築
再生医療等製品の製造においては、GCTP(Good Gene, Cellular, and Tissue-based Products Manufacturing Practice)省令への準拠が必須です。これは、製品の品質を一定に保つためのハード面(構造設備)とソフト面(手順書・記録・管理体制)の両方を規定したものです。
研究室レベルでは許容されていた手作業や記録の管理も、GCTP下では厳密なSOP(標準作業手順書)に基づいた運用が求められます。無菌操作の保証、交叉汚染の防止、製造記録の完全性など、徹底した管理体制を構築しなければなりません。治験薬製造の段階からGCTPに準拠した体制を整備しておくことが、将来の承認申請への近道となります。
GLP適用下での安全性試験データの取得
非臨床安全性試験、特に毒性試験や安全性薬理試験などは、原則としてGLP(Good Laboratory Practice)基準に適合した施設で実施する必要があります。GLPは、試験データの信頼性を保証するための基準であり、職員の教育訓練、試験計画書の遵守、データの記録・保管などが厳しく定められています。
アカデミアの研究室がGLP認証を取得しているケースは稀であるため、通常はGLP適合施設を持つ外部の受託研究機関(CRO)などに試験を委託することになります。信頼性の高いデータを取得することは、ヒトへの投与リスクを評価する上で最も重要な基盤となります。
原材料の生物由来原料基準への適合性確認
再生医療では、培地や試薬にウシ血清などの生物由来原料を使用することが多くあります。これらを使用する場合、「生物由来原料基準」への適合性を確認しなければなりません。これは、原料由来の感染症リスク(ウイルスやプリオンなど)を排除するための基準です。
可能な限り動物由来成分を含まない(Xeno-free)原料への切り替えが推奨されますが、使用せざるを得ない場合は、原産国の安全性、不活化処理の有無、ウイルス否定試験の結果などを証明する文書が必要です。開発の後期になってからの変更は困難なため、初期段階で原材料の適格性を厳密にチェックしましょう。
特性解析と不純物の管理基準設定
細胞製品は「生きた薬」であるため、低分子医薬品のように純度100%を目指すことは困難ですが、製品の特性を定義し、不純物を管理することは求められます。これを「特性解析」と呼びます。
具体的には、細胞表面マーカー、分泌タンパク質、遺伝子発現パターンなどで細胞の同一性を確認するとともに、目的外の細胞や試薬の残留物、ウイルス等の不純物が許容限度内であることを示さなければなりません。これらの規格値や試験方法は、開発段階が進むにつれて精緻化していきますが、TR段階で科学的根拠に基づいた暫定的な基準を設定しておく必要があります。
PMDA(医薬品医療機器総合機構)の対面助言・相談制度の活用手順
の対面助言・相談制度の活用手順-scaled.jpg)
トランスレーショナルリサーチを円滑に進めるためには、規制当局であるPMDA(医薬品医療機器総合機構)との対話が欠かせません。PMDAの相談制度を有効活用することで、開発の方向性を修正し、無駄な試験を避けることができます。ここでは、相談制度の活用手順とポイントを紹介します。
レギュラトリーサイエンス戦略相談の活用メリット
PMDAの「レギュラトリーサイエンス戦略相談(RS戦略相談)」は、アカデミアやベンチャー企業が開発初期段階から規制要件について相談できる制度です。この相談を活用する最大のメリットは、開発の早い段階で「規制当局の視点」を取り入れられる点にあります。
例えば、必要な非臨床試験の項目や、品質管理の方向性について助言を得ることで、承認申請に繋がらない無駄な実験を省くことができます。また、担当審査官との顔合わせができるため、その後のコミュニケーションが円滑になるという側面もあります。自分たちの開発ロジックが規制側通用するかどうか、まずはこの場で確認してみましょう。
再生医療等製品事前面談での論点整理
本格的な対面助言(有料)を申し込む前に、「事前面談」を行うことが一般的です。これは、対面助言で議論すべき論点を整理し、相談の質を高めるためのプロセスです。
事前面談では、相談したい内容の概要を説明し、PMDA側から「その内容ならどの相談区分が適切か」「どのような資料を準備すべきか」といったアドバイスを受けます。ここで論点を明確にしておかないと、本番の対面助言で「資料不足で回答できない」と言われてしまうリスクがあります。聞きたいことを絞り込み、効果的なディスカッションができるよう準備を整えましょう。
対面助言に向けた資料作成とシミュレーション
対面助言の日程が決まったら、詳細な相談資料を作成し、事前に提出します。この資料は、相談の成否を分ける極めて重要なものです。開発の経緯、試験データ、そして「我々はこう考えるが、これでよいか」という質問事項と自社の見解(提案)を論理的に記述する必要があります。
資料提出後は、当日の質疑応答を想定したシミュレーション(模擬問答)を繰り返し行います。PMDAからの鋭い指摘に対し、科学的かつ合理的に回答できるよう、専門家やコンサルタントを交えてリハーサルを行うことをお勧めします。準備の深さが、相談結果の質に直結します。
相談記録の確定と開発計画への反映
対面助言終了後は、速やかに議事録(相談記録)を作成し、PMDAと内容の確認を行います。この相談記録は、PMDAとの「合意文書」として機能し、後の承認審査においても重要な証拠書類となります。
「言った、言わない」のトラブルを避けるためにも、助言内容を一言一句正確に記録し、双方で確定させることが重要です。確定した相談記録に基づき、開発計画やプロトコルを修正・最適化します。このサイクルを回すことで、規制要件に完全に適合した開発ロードマップが完成していきます。
トランスレーショナルリサーチを成功させるための体制構築
トランスレーショナルリサーチは、一人の研究者や一つの組織だけで完遂できるものではありません。多岐にわたる専門知識と膨大なリソースが必要となるため、適切な体制構築が成功の鍵を握ります。ここでは、TRを推進するためのチームビルディングや外部リソースの活用について解説します。
産学連携における役割分担の明確化
アカデミア発のシーズを開発する場合、大学(研究機関)と企業との連携が不可欠です。この際、役割分担を明確にすることが重要です。アカデミアは「科学的妥当性の証明」や「作用機序の解明」といった研究開発のコア部分を担い、企業側は「GCTP製造」「薬事対応」「事業開発」といった実用化に向けた実務を担うのが一般的です。
双方が互いの文化や言語(科学用語とビジネス用語)の違いを理解し、共通のゴール(患者様への提供)に向かって協働できる体制を作ることが、プロジェクト停滞を防ぐ第一歩です。契約段階で知財の取り扱いや成果配分についても明確にしておきましょう。
専門CRO(開発業務受託機関)の選定と活用
自前ですべてのリソースを賄うのは非効率的です。必要に応じて専門のCRO(開発業務受託機関)やCDMO(医薬品製造開発受託機関)を選定し、活用しましょう。特に、非臨床安全性試験や治験モニタリング、GMP製造などは、実績のあるプロフェッショナルに委託することで、品質とスピードを担保できます。
選定の際は、単にコストだけで選ぶのではなく、再生医療分野での実績や、PMDA対応の経験値などを重視してください。パートナーとしての信頼関係を築けるCROを見つけることが、開発加速のエンジンとなります。
資金調達と公的グラント(AMED等)の活用
TRには多額の資金が必要です。ベンチャーキャピタルや製薬企業からの投資だけでなく、公的グラントの活用も積極的に検討しましょう。日本では、AMED(日本医療研究開発機構)などが再生医療の実用化研究に対して大型の助成金を提供しています。
これらの公的資金は、返済義務がないだけでなく、採択されること自体がプロジェクトの信頼性向上(お墨付き)につながります。ただし、申請には詳細な開発計画や出口戦略が求められるため、前述のTPPやロードマップの策定がここでも活きてきます。資金調達のポートフォリオを多様化し、財務的な安定性を確保しましょう。
プロジェクトマネジメント機能の強化
最後に、これら全ての要素を統括する「プロジェクトマネジメント(PM)」機能の強化です。研究、製造、臨床、薬事、知財、資金調達など、各パートがバラバラに動いていてはTRは進みません。全体を俯瞰し、進捗を管理し、問題が発生した際に迅速に意思決定を行うリーダーシップが必要です。
専任のプロジェクトマネージャーを配置し、定期的なミーティングで情報を共有する仕組みを作りましょう。PMは、科学とビジネスの両方の言語を理解し、多様なステークホルダーをつなぐ翻訳者としての役割も果たします。強固なPM体制こそが、TR成功の要です。
まとめ
トランスレーショナルリサーチの進め方について、出口戦略からの逆算思考、具体的なロードマップ、規制対応、そして体制構築の観点から解説しました。
重要なポイントは以下の3点です。
- TPP(出口戦略)の早期策定: ゴールから逆算して必要なデータを定義する
- 規制要件への適合: GCTP/GLPやPMDA相談を開発プロセスに組み込む
- チームによる開発: 産学連携やCRO活用で「死の谷」を越える体制を作る
基礎研究の成果を臨床へ届ける道のりは険しいですが、適切な戦略と手順を踏めば、必ず道は拓けます。先生方の素晴らしいシーズが、一日も早く患者様のもとへ届くことを心より願っております。
トランスレーショナルリサーチの進め方についてよくある質問

トランスレーショナルリサーチを進めるにあたり、多くの研究者や開発担当者から寄せられる質問をまとめました。
-
Q. TPP(ターゲット・プロダクト・プロファイル)はいつ頃作成すべきですか?
- A. 可能な限り早期、理想的には基礎研究から非臨床試験へ移行する段階で作成を開始することをお勧めします。早期に作成することで、必要な試験項目や開発方針が明確になり、手戻りを防ぐことができます。
-
Q. PMDAの相談にはどのタイミングで行くのがベストですか?
- A. 開発の節目ごとに活用すべきですが、まずは「レギュラトリーサイエンス戦略相談」を開発初期(非臨床試験開始前など)に利用するのが効果的です。試験計画の妥当性を早期に確認できます。
-
Q. アカデミアの研究室で製造した細胞をそのまま治験に使えますか?
- A. そのままでは使用できません。治験に使用する製品は、GCTP(またはGMP)基準に適合した製造施設で、厳格な品質管理の下で製造される必要があります。
-
Q. 「死の谷」を乗り越えるために最も重要なことは何ですか?
- A. 科学的なエビデンスだけでなく、「規制への適合性」と「知的財産の確保」を同時に進めることです。企業が投資しやすいパッケージにしておくことが重要です。
-
Q. 専門のCROに委託するメリットは何ですか?
- A. GLP等の規制要件に精通しており、高品質なデータを効率的に取得できる点です。また、申請資料作成のノウハウも豊富なため、開発スピードを加速させることができます。
<script type="application/ld+json">
{
"@context": "https://schema.org",
"@type": "FAQPage",
"mainEntity": [
{
"@type": "Question",
"name": "TPP(ターゲット・プロダクト・プロファイル)はいつ頃作成すべきですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "可能な限り早期、理想的には基礎研究から非臨床試験へ移行する段階で作成を開始することをお勧めします。早期に作成することで、必要な試験項目や開発方針が明確になり、手戻りを防ぐことができます。"
}
},
{
"@type": "Question",
"name": "PMDAの相談にはどのタイミングで行くのがベストですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "開発の節目ごとに活用すべきですが、まずは「レギュラトリーサイエンス戦略相談」を開発初期(非臨床試験開始前など)に利用するのが効果的です。試験計画の妥当性を早期に確認できます。"
}
},
{
"@type": "Question",
"name": "アカデミアの研究室で製造した細胞をそのまま治験に使えますか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "そのままでは使用できません。治験に使用する製品は、GCTP(またはGMP)基準に適合した製造施設で、厳格な品質管理の下で製造される必要があります。"
}
},
{
"@type": "Question",
"name": "「死の谷」を乗り越えるために最も重要なことは何ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "科学的なエビデンスだけでなく、「規制への適合性」と「知的財産の確保」を同時に進めることです。企業が投資しやすいパッケージにしておくことが重要です。"
}
},
{
"@type": "Question",
"name": "専門のCROに委託するメリットは何ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "GLP等の規制要件に精通しており、高品質なデータを効率的に取得できる点です。また、申請資料作成のノウハウも豊富なため、開発スピードを加速させることができます。"
}
}
]
}
</script>



