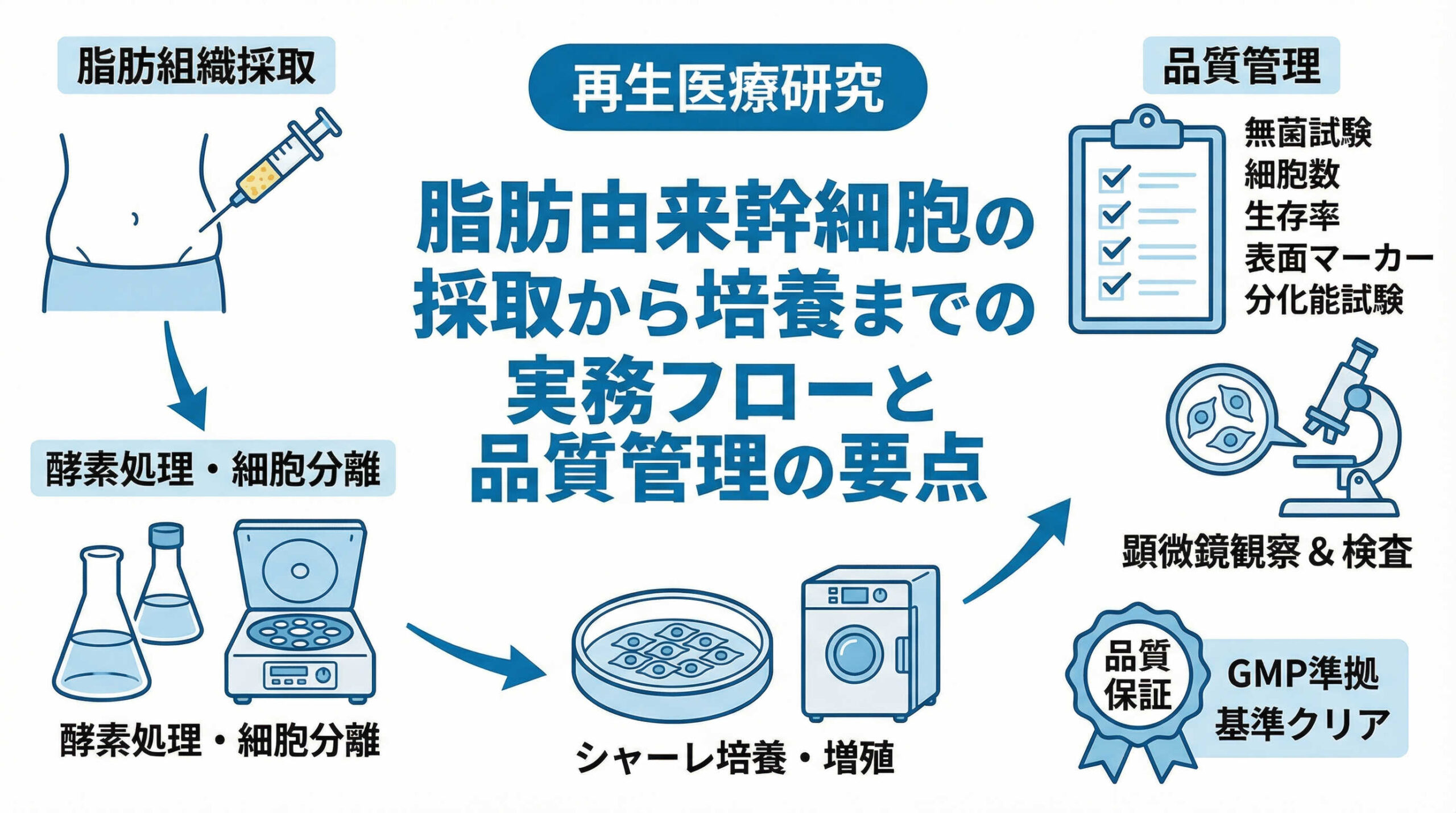
再生医療の現場において、脂肪由来幹細胞(Adipose-derived Stem Cells: ASC)は、その採取の容易さと多分化能から、多くの治療プロトコルで中心的な役割を果たしています。しかし、細胞製剤の品質を一定に保ち、高い治療効果と安全性を担保するためには、採取から培養、最終製品化に至るまでの各工程において、厳格な管理と高度な技術が求められます。
本記事では、再生医療に従事される医師や培養士の方々に向けて、脂肪由来幹細胞の採取・培養プロセスの標準的なフローと、実務における重要管理点(CCP)を詳細に解説いたします。これから細胞加工施設の運用を本格化される施設様や、SOP(標準作業手順書)の見直しを検討されている担当者様にとって、日々の業務の一助となれば幸いです。
脂肪由来幹細胞(ASC)の採取・培養プロセスの標準フローと重要管理点
の採取・培養プロセスの標準フローと重要管理点-1-scaled.jpg)
脂肪由来幹細胞(ASC)の採取から最終製品化に至るプロセスは、複数の複雑な工程が連鎖しており、どの段階においても些細な逸脱が最終的な細胞品質に大きく影響いたします。まずはプロセス全体の標準的な流れを把握し、どこにリスクが潜んでいるかを理解することが、安全な再生医療を提供する第一歩となります。ここでは、全体工程の俯瞰と、法的根拠に基づく品質管理の考え方について解説いたします。
脂肪採取から最終製剤化までの全体工程図
脂肪由来幹細胞の製造工程は、大きく分けて「組織採取」「細胞分離」「拡大培養」「製品化」の4つのフェーズで構成されます。各工程は連続しており、前の工程の結果が次の工程の成否を決定づけます。
標準的な全体工程フロー:
- 原材料採取: 脂肪吸引による組織採取
- 輸送: 温度管理下でのCPC(細胞培養加工施設)への搬送
- 細胞分離: 酵素処理によるSVF(間質血管細胞群)の抽出
- 初代培養: フラスコへの播種と定着
- 継代培養: 細胞数の拡大と純化
- 凍結・保管: 細胞バンクの構築
- 品質試験: 無菌試験や特性解析
- 最終調製: 投与用製剤への加工
このフロー全体を通して、トレーサビリティを確保し、各段階での記録を残すことが不可欠です。
再生医療等安全性確保法に基づく品質基準の考え方
日本国内において細胞加工を行う場合、「再生医療等の安全性の確保等に関する法律(再生医療等安全性確保法)」を遵守しなければなりません。この法律では、細胞加工物の製造管理および品質管理の基準(GCTPに準拠した考え方)が求められます。
具体的には、以下の要素が重要となります。
- 均質性の確保: 常に一定の品質の細胞を提供できる体制
- 安全性の確保: 無菌性の保証と外来性ウイルスの否定
- 有効性の維持: 細胞の生存率や機能性の保持
法令は単なるルールではなく、患者様の安全を守るための最低限の基準であると捉え、施設のSOPに落とし込むことが大切です。
細胞加工物の安全性と有効性を担保する重要管理点(CCP)
製造プロセスの中で、特に品質や安全性に重大な影響を及ぼすポイントを「重要管理点(CCP: Critical Control Point)」として設定し、重点的に管理します。
主な重要管理点の例:
- 原材料受け入れ時: 汚染や容器破損の有無
- 酵素処理工程: 温度と時間の厳守(過処理による細胞ダメージ防止)
- 無菌操作時: キャビネット内の清浄度維持
- 最終製品検査: 規格適合性の判定
これらのポイントで逸脱が発生した場合の対応手順(是正措置)をあらかじめ定めておくことで、トラブル発生時にも冷静かつ迅速な対応が可能となります。リスクベースアプローチで管理体制を構築しましょう。
原材料となる脂肪組織の採取手技と輸送管理
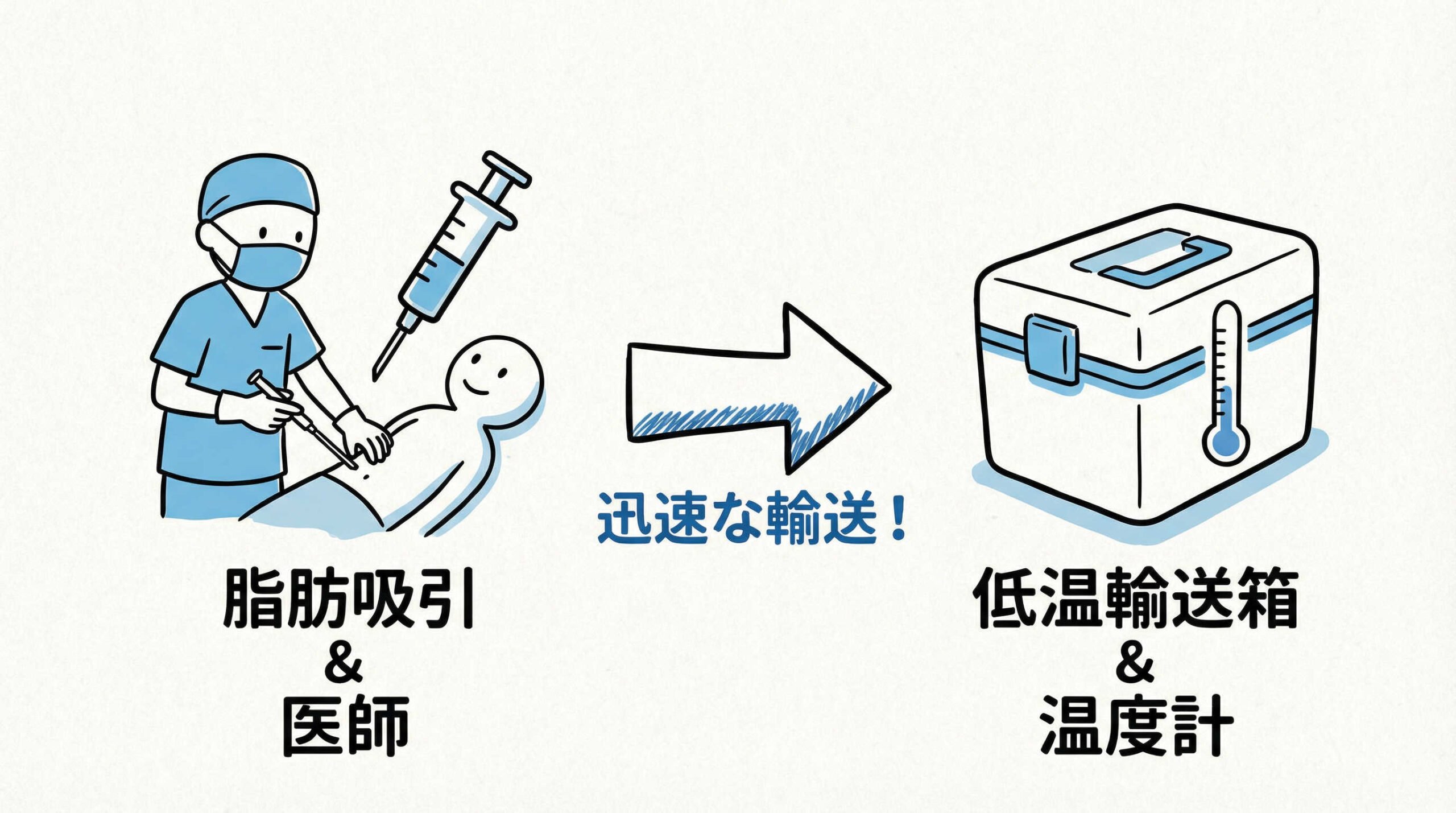
細胞培養のスタート地点である原材料、すなわち脂肪組織の状態は、最終的な細胞の収量や増殖能に直結します。適切な手技で採取された脂肪組織を、細胞の活力を維持したまま加工施設へ届けることは、高品質な幹細胞製剤を作るための必須条件です。ここでは、臨床現場での採取手技と、加工施設への輸送における管理ポイントについて詳しく見ていきましょう。
脂肪吸引におけるTumescent法と採取部位の選定
脂肪吸引の手技自体が細胞の生存率に影響を与えることが知られています。一般的には、Tumescent(チューメセント)法を用い、局所麻酔薬と血管収縮薬を含む生理食塩水を注入してから吸引を行いますが、麻酔薬の種類や濃度、吸引圧の設定には注意が必要です。
採取のポイント:
- 部位の選定: 腹部や大腿部が一般的ですが、採取部位による幹細胞含有率の違いも考慮します。
- 吸引圧: 過度な陰圧は細胞に物理的ダメージを与えるため、愛護的な操作を心がけます。
- カニューレ操作: 機械的な剪断力を最小限に抑えるよう操作します。
良質な脂肪組織を採取することが、その後の培養成功の鍵を握っています。
採取時のコンタミネーションを防ぐための無菌操作
脂肪採取は手術室などの清浄な環境で行われますが、採取容器への充填や密閉の瞬間にコンタミネーション(汚染)のリスクが潜んでいます。閉鎖式の吸引システムを使用することで、外気との接触を最小限に抑えることが推奨されます。
無菌操作の徹底:
- 清潔野の確保: 採取キットや容器の取り扱いは清潔操作を厳守します。
- 迅速な密閉: 採取後は速やかに輸送容器へ移し、密閉します。
- 消毒: 容器外側をアルコール等で清拭し、汚染の持ち込みを防ぎます。
初期段階での汚染は、その後の培養工程での細菌増殖に直結するため、細心の注意を払いましょう。
輸送容器の選定と温度管理(輸送バリデーション)
採取した脂肪組織をCPCへ輸送する際は、細胞の活性を維持するための温度管理が極めて重要です。一般的には、急激な温度変化を避け、細胞代謝を抑制しつつ凍結を防ぐ温度帯(例えば2〜8℃、あるいは常温など、施設のプロトコルによる)での輸送が選択されます。
輸送バリデーションの要素:
- 専用容器: 断熱性と衝撃吸収性に優れたバイオハザード対応容器を使用。
- 温度ロガー: 輸送中の温度推移を記録し、逸脱がないか確認。
- 時間管理: 採取から加工開始までの許容時間を設定(例:24時間以内)。
季節による外気温の影響も考慮し、バリデーション済みの輸送梱包を使用することが求められます。
原材料受け入れ時の外観確認と記録
CPCに脂肪組織が到着した際には、直ちに受け入れ検査を行います。これは、加工工程に投入する前の最後の砦となります。
確認・記録項目:
- 個体識別: 依頼書と検体ラベルの照合(患者ID、氏名等)。
- 容器の状態: 破損、液漏れ、封印の有無。
- 検体の状態: 血液の混入度合い、色調、異物の有無。
- 輸送記録: 温度ロガーのデータ確認。
これらの情報を詳細に記録し、基準を満たさない場合は加工を中止する判断も必要です。適切な記録管理は、トレーサビリティ確保の基本となります。
酵素処理による細胞分離とSVFの回収手順
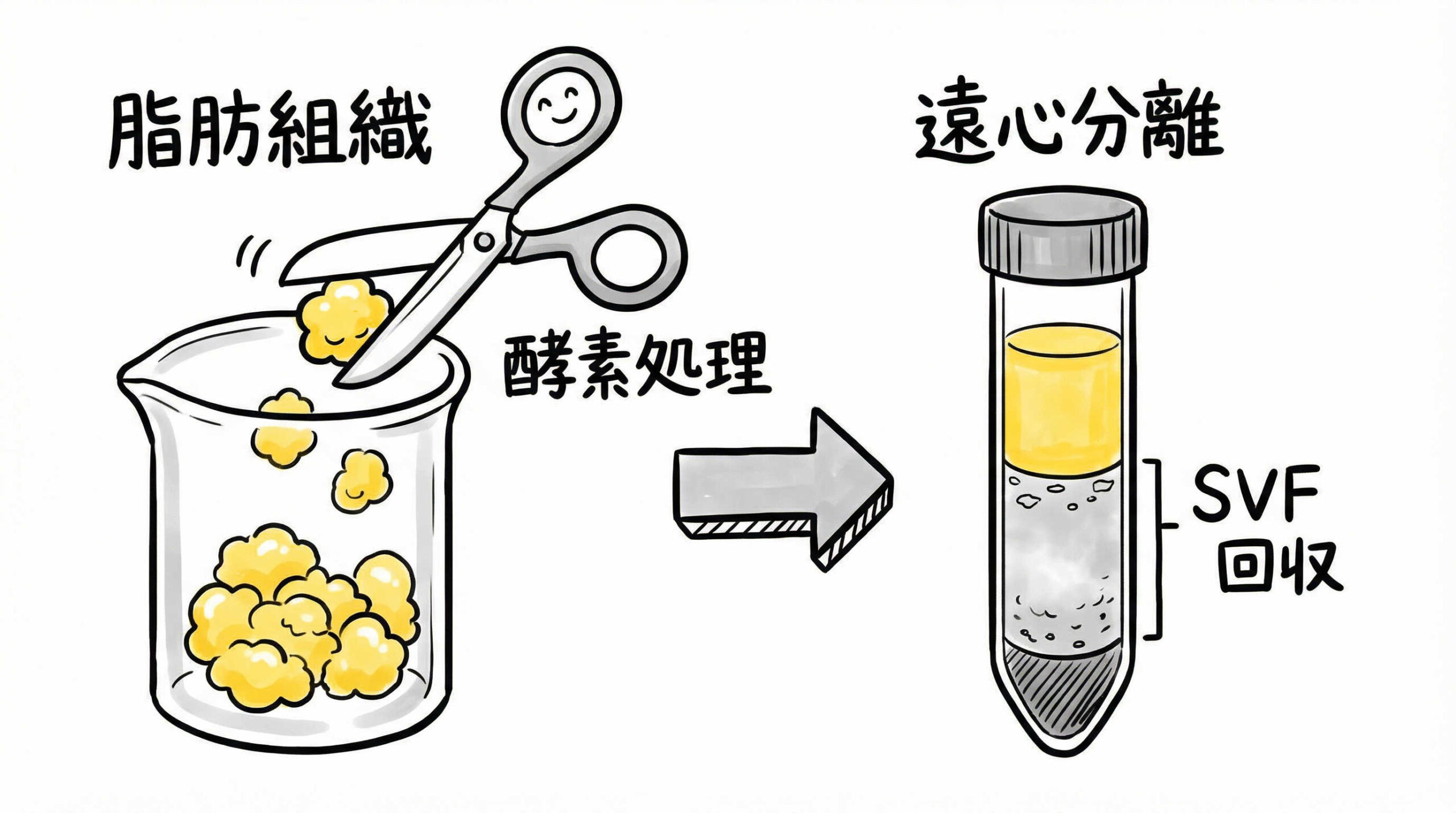
脂肪組織から幹細胞を含むSVF(Stromal Vascular Fraction)を効率よく回収するためには、酵素処理による組織の消化と分離が欠かせません。この工程は、コラゲナーゼの活性や処理条件によって細胞の回収率や生存率が大きく変動するため、プロトコルの最適化が求められます。ここでは、脂肪組織の洗浄からSVFペレットの取得までの技術的な詳細を解説します。
脂肪組織の洗浄と血液成分の除去プロセス
受け入れた脂肪組織には、血液成分、麻酔液、油滴などが含まれています。これらは酵素反応を阻害したり、培養初期の細胞接着を妨げたりする要因となるため、酵素処理の前に十分に洗浄除去する必要があります。
洗浄プロセスの要点:
- 洗浄液: PBS(リン酸緩衝生理食塩水)などを用います。
- 操作: 遠心分離や自然沈降を利用し、上層の油分と下層の血液・水分を除去します。
- 終点: 洗浄液が透明になり、組織が黄色味を帯びるまで繰り返します。
赤血球の混入は後の細胞数計測のノイズにもなるため、丁寧な洗浄が推奨されます。
コラゲナーゼを用いた酵素処理の最適条件と反応時間
脂肪組織の細胞外マトリックスを分解し、細胞をバラバラにするためにコラゲナーゼ(コラーゲン分解酵素)を使用します。酵素の濃度、種類、処理温度、時間は、細胞の収率とダメージのバランスを見て決定します。
最適化のポイント:
- 温度: 一般的には37℃の恒温振盪機を使用します。
- 時間: 30分〜60分程度が目安ですが、組織片が消失するまで過不足なく行います。
- 撹拌: 穏やかな振盪により、酵素を組織全体に行き渡らせます。
処理時間が長すぎると細胞表面タンパクが損傷し、短すぎると回収率が低下します。ロットごとの酵素活性の違いにも注意が必要です。
遠心分離によるSVF(間質血管細胞群)のペレット回収
酵素処理後の懸濁液には、脂肪細胞(Adipocytes)とSVFが含まれています。これらを比重の違いを利用して分離します。
遠心分離の手順:
- 条件: 一般的に400〜600g程度で5〜10分間遠心します。
- 分離: 上層に浮く脂肪細胞と油分、中層の酵素液を除去し、底に沈殿したSVFペレットを回収します。
- 再懸濁: 回収したペレットを洗浄液または培地で再懸濁し、残留酵素を洗い流します。
SVFペレットを目視で確認し、赤血球の混入が多い場合は溶血処理を追加することもあります。確実なペレット回収が培養のスタートラインです。
フィルタリングによる組織片除去と細胞懸濁液の作製
回収したSVF懸濁液には、未消化の組織片や結合組織の残骸が含まれていることがあります。これらを除去し、単一細胞(シングルセル)の状態にするためにフィルタリングを行います。
フィルタリングの注意点:
- ポアサイズ: 通常、100µmまたは70µmのセルストレーナーを使用します。
- 操作: 目詰まりを起こさないよう、ゆっくりと通します。必要に応じて新しいフィルターに交換します。
- 洗浄: フィルターに残った細胞を回収するため、少量の培地で洗い流します。
この工程を経ることで、均一な細胞懸濁液が得られ、正確な細胞数計測と培養播種が可能になります。
初代培養から継代培養における増殖管理と操作技術
分離されたSVFから脂肪由来幹細胞(ASC)を選択的に増殖させる培養工程は、細胞製剤の品質を決定づける最も長いプロセスです。細胞の形態や増殖スピードを日々観察し、適切なタイミングで継代を行う職人技とも言える管理能力が問われます。ここでは、初代培養から継代培養における具体的な操作技術と管理指標について詳述します。
適切な播種密度の設定と培地選択のポイント
初代培養(P0)は、SVF中のASCをフラスコ底面に接着させ、選択的に増殖させる段階です。SVF中のASC含有率は数%程度であるため、適切な播種密度の設定が重要です。
設定のポイント:
- 播種密度: 過密すぎると接着効率が落ち、過疎すぎると増殖シグナルが弱まります。経験的に適切な細胞数を設定します(例: 数千〜数万cells/cm²)。
- 培地: 無血清培地や低血清培地など、目的に応じた培地を選択します。近年は安全性考慮のため、ウシ胎児血清(FBS)を含まない培地の利用も増えています。
最初の接着(プレーティング)が成功するかどうかが、その後の増殖を左右します。
培養環境の維持(温度・CO2濃度・湿度)と培地交換頻度
細胞にとって快適な環境を24時間365日維持することが、安定培養の基本です。インキュベーター内の環境は厳密に管理されるべきです。
環境管理項目:
- 温度: 37℃ ± 0.5℃
- CO2濃度: 5%(培地のpH維持のため)
- 湿度: 95%以上(培地の蒸発防止)
培地交換:
細胞の代謝により栄養が枯渇し、老廃物が蓄積します。通常は2〜3日に1回、培地交換を行います。培地の色調変化(pH指示薬)も交換時期の目安となりますが、スケジュールを決めて定期的に行うことが一般的です。
位相差顕微鏡による形態観察と異常の早期発見
毎日の顕微鏡観察は、培養士の最も重要なルーチンワークです。細胞の形、密度、不純物の有無などをチェックし、異常の兆候を見逃さないようにします。
観察のポイント:
- 形態: ASC特有の紡錘形(スピンドルシェイプ)をしているか。
- 異常: 空胞化、巨大化、剥離などの老化サインやストレスサインがないか。
- 汚染: 細菌による混濁や、カビの菌糸が見られないか。
異常を感じたら、直ちに隔離や廃棄、原因究明のフローに移れるよう、正常な状態を深く理解しておくことが大切です。
コンフルエンシーの判断基準と継代のタイミング
細胞がフラスコの底面を覆う割合をコンフルエンシーと呼びます。継代培養に移るタイミングは、このコンフルエンシーで判断します。
継代の基準:
- 適正範囲: 一般的に80〜90%コンフルエントで継代します。
- リスク: 100%を超えて過密になると、接触阻害により増殖が停止したり、細胞の性質が変化したりする恐れがあります。逆に早すぎると、増殖効率が悪くなります。
週末や祝日のスケジュールも考慮しつつ、細胞の状態に合わせて柔軟に継代計画を立てる必要があります。
トリプシン処理による細胞剥離と回収率向上のコツ
フラスコに接着した細胞を剥がして回収する工程です。トリプシンなどのタンパク質分解酵素を用いますが、細胞へのダメージを最小限にする技術が求められます。
操作のコツ:
- 洗浄: 培地中の血清成分などが酵素を阻害するため、PBSで洗浄してから酵素を加えます。
- 反応: 顕微鏡で細胞が丸くなるのを観察しながら、必要最小限の時間で処理します。
- 停止: 酵素反応を止める(中和する)液を加え、ピペッティングで優しく細胞を分散させます。
回収率を高めつつ、生存率(Viability)を維持することが、次世代の培養成績につながります。
細胞の凍結保存・融解プロセスと在庫管理

培養して増やした細胞は、必要な時期まで凍結保存するか、あるいは治療スケジュールに合わせて一時的に保管されます。細胞の機能を損なわずに長期間保存し、必要な時に高い生存率で蘇生させるためには、凍結と融解のプロセスにおける物理化学的なストレス制御が鍵となります。ここでは、細胞バンク構築にも関わる保存技術について解説します。
凍結保護液の組成とDMSOの毒性管理
細胞を凍結する際、氷晶形成による細胞膜の破壊を防ぐために凍結保護液を使用します。最も一般的な保護剤はDMSO(ジメチルスルホキシド)ですが、常温では細胞毒性を持つため取り扱いには注意が必要です。
管理のポイント:
- 組成: 通常、10%程度のDMSOを含む保存液を使用します。血清成分やアルブミンを添加して保護効果を高めることもあります。
- 操作: 保存液を加えたら、細胞がDMSOに曝露される時間を短くするため、速やかに冷却プロセスへ移行します。
最近では、DMSOフリーの保存液も開発されており、用途に応じて選択肢が広がっています。
プログラムフリーザーを用いた緩慢凍結法の手順
細胞内の水分を適切に脱水させながら凍結するために、プログラムフリーザーや専用の凍結容器(バイセル等)を用いて、ゆっくりと温度を下げていく「緩慢凍結法」が採用されます。
冷却速度の目安:
- 速度: 一般的に毎分-1℃の速度で冷却することが理想とされています。
- 手順: -80℃までゆっくり冷却した後、液体窒素気相中へ移動させます。
急激な温度低下は細胞内氷晶の形成を招き、細胞死の原因となるため、温度降下プロファイルの管理は品質維持に直結します。
液体窒素タンクでの保管管理と検体識別システム
凍結された細胞は、液体窒素タンク(気相中、約-150℃以下)で半永久的に保管されます。ここでは、検体の取り違え防止と在庫管理が重要になります。
管理システム:
- ロケーション管理: タンク内のラック、ボックス、位置番号を厳密に記録します。
- 識別ラベル: 耐寒性ラベルを用い、バーコードやQRコードで管理することでヒューマンエラーを防ぎます。
- 液体窒素残量: 定期的な補充とモニタリングを行い、保管温度の逸脱を防ぎます。
必要な検体を即座に取り出せる整理整頓された環境は、緊急時のリスクヘッジにもなります。
細胞生存率を維持するための急速融解手順
凍結細胞を使用する際は、凍結時とは逆に「急速融解」を行うのが鉄則です。緩慢に溶かすと、再結晶化や氷晶の成長により細胞がダメージを受けるからです。
融解の手順:
- 加温: 37℃の恒温槽(ウォーターバス)を使用し、凍結チューブを振盪しながら急速に解凍します。
- タイミング: 氷塊がわずかに残る程度で加温を止めます。
- 洗浄: 直ちに多量の培地や洗浄液に懸濁し、遠心分離を行ってDMSOを除去します。
「急速融解・即時洗浄」が、融解後の高い生存率を確保するための合言葉です。
細胞加工物の品質管理試験(QC)と出荷判定基準
と出荷判定基準-1-scaled.jpg)
最終的に患者様に投与される細胞加工物は、厳格な品質基準を満たしていなければなりません。製造された細胞が安全であり、かつ期待される特性を持っていることを科学的に証明するのが品質管理試験(QC)です。ここでは、出荷判定のために実施すべき主要な試験項目と、その判定基準について解説します。
無菌試験およびマイコプラズマ否定試験の実施
患者様の体内に直接投与されるため、無菌性の保証は絶対条件です。
試験内容:
- 無菌試験: 細菌や真菌の混入がないことを、培養法(直接法や膜ろ過法)を用いて確認します。結果判明までに14日間程度要するため、迅速法の導入も検討されます。
- マイコプラズマ否定試験: 一般的な細菌試験では検出できないマイコプラズマの汚染がないことを、PCR法や培養法で確認します。
これらの試験は、工程内管理(中間製品)および最終製品の両方で実施することが望ましいでしょう。
エンドトキシン試験による発熱性物質の確認
エンドトキシンは、グラム陰性菌の細胞壁成分であり、微量でも患者様に発熱やショック症状を引き起こす可能性があります。
試験のポイント:
- ライセート試薬: カブトガニ血球抽出成分を用いた比色法や比濁法で測定します。
- 基準値: 体重あたりの投与量に基づき、安全な上限値を設定します(例:5.0 EU/kg未満など)。
試薬や資材由来のエンドトキシン汚染にも注意が必要であり、使用するすべての物品についてエンドトキシンフリーを確認します。
フローサイトメトリーによる表面マーカー解析(陽性・陰性)
製造した細胞が間違いなく「脂肪由来幹細胞(ASC)」であることを証明するために、細胞表面の特定のタンパク質(表面マーカー)を解析します。
国際細胞治療学会(ISCT)等の基準:
- 陽性マーカー: CD90, CD73, CD105などが95%以上陽性であること。
- 陰性マーカー: CD45(白血球), CD31(血管内皮), CD11b, CD19, HLA-DRなどが2%以下であること。
フローサイトメーターを用いて集団としての純度を数値化し、品質を担保します。
細胞数計測と生存率の算出方法
投与に必要な細胞数が確保されているか、そしてその細胞が生きているかを確認します。
測定方法:
- トリパンブルー染色法: 死細胞が青く染まる原理を利用し、血球計算盤や自動セルカウンターで計測します。
- 蛍光染色法: より精度の高い核染色法を用いることもあります。
基準:
一般的に、最終製品の生存率は70%以上、あるいは施設基準によっては80〜90%以上が求められます。正確な細胞数カウントは、投与量の決定に直結する重要なデータです。
最終製品の規格設定と出荷判定フロー
すべての試験結果が出揃った後、品質保証責任者による最終的な出荷判定が行われます。
判定フロー:
- 製造記録の査読: 全工程がSOP通りに行われ、逸脱がないか。
- 試験結果の照合: 全てのQC項目が規格値内(Specification)に収まっているか。
- 出荷可否の決定: 総合的に判断し、出荷承認(Release)の署名を行います。
規格外(OOS: Out of Specification)となった場合の処理手順も事前に定めておく必要があり、安易な出荷は厳に慎まなければなりません。
細胞培養加工施設(CPC)の運用とSOP策定のポイント
の運用とSOP策定のポイント-1-scaled.jpg)
高品質な細胞を安定的に製造するためには、技術だけでなく、それを支える施設(ハードウェア)と管理体制(ソフトウェア)の両輪が必要です。細胞培養加工施設(CPC)の適切な運用と、実効性のある標準作業手順書(SOP)の整備は、再生医療を提供する医療機関や企業の責務です。最後に、施設運用と文書管理のポイントを整理します。
構造設備基準を満たす区域管理と清浄度維持
CPCは、清浄度レベルに応じた区域管理(ゾーニング)がなされている必要があります。
管理の要点:
- 気圧制御: 清潔区域を陽圧に保ち、外部からの汚染侵入を防ぎます。
- 動線分離: 人と物の動きを一方向(ワンウェイ)にし、交差汚染を防止します。
- 清掃・モニタリング: 定期的な清掃消毒と、落下菌・浮遊菌・表面付着菌の測定を行い、環境が維持されていることを監視します。
ハードウェアが基準を満たしていても、運用がおろそかであれば清浄度は維持できません。入退室管理や更衣手順の徹底も重要です。
特定細胞加工物製造届出に必要な標準作業手順書(SOP)の整備
特定細胞加工物の製造届出を行うには、製造および品質管理に関する基準書や手順書(SOP)の作成が必須です。
SOPの構成要素:
- 製造手順: 詳細な作業フロー。
- 機器保守: インキュベーターやキャビネットの点検手順。
- 衛生管理: 清掃や更衣の手順。
- 緊急時対応: 停電や機器故障時の対応。
SOPは「作って終わり」ではなく、実務に合わせて定期的に見直し(改訂)を行い、現場の作業者が迷わず動ける生きた文書にすることが大切です。
試薬・資材の管理とロットトレーサビリティの確保
細胞培養には多くの試薬(培地、酵素、緩衝液)や資材(フラスコ、ピペット)を使用します。これらが品質に悪影響を与えないよう管理する必要があります。
管理項目:
- 受入検査: 規格、使用期限、破損の有無を確認。
- 保管管理: 適切な温度(冷蔵、冷凍、常温)での保管。
- トレーサビリティ: どのロットの試薬をどの細胞製造に使用したか、後から追跡できるように記録します。
特に生物由来原料(血清など)を使用する場合は、ウイルス安全性などの証明書(CoA)の保管も重要です。
作業者の教育訓練と製造記録の適正管理
どんなに設備が立派でも、実際に作業を行うのは「人」です。作業者のスキルとコンプライアンス意識が品質を左右します。
教育と記録:
- 教育訓練: 無菌操作、SOP理解、法令遵守に関する定期的な研修を実施します。
- スキル評価: 手技の認定制度などを設け、一定レベル以上の者のみが製造に従事できるようにします。
- 記録の保存: 製造記録、試験記録、教育記録などは、法令で定められた期間(通常10年以上)保存する義務があります。
「記録がないものは実施していないのと同じ」というGMP(Good Manufacturing Practice)の精神を浸透させることが肝要です。
まとめ
脂肪由来幹細胞の採取から培養、そして最終製品化までのプロセスは、科学的な根拠に基づいた緻密な作業の積み重ねです。原材料の適切な採取と輸送、酵素処理による効率的な分離、厳密な環境下での培養管理、そして徹底した品質管理試験。これら全ての工程がリンクし、高いレベルで管理されて初めて、患者様に安全で有効な再生医療を提供することが可能になります。
本記事で解説した各工程の重要管理点(CCP)や運用ポイントは、あくまで標準的なガイドラインです。実際の運用においては、各施設の設備や治療目的に合わせてSOPを最適化し、常に改善を続けていく姿勢が求められます。確かな技術と管理体制で、再生医療の発展に貢献していきましょう。
脂肪由来幹細胞の採取・培養プロセスについてよくある質問
脂肪由来幹細胞の採取・培養プロセスに関して、現場の実務担当者からよく寄せられる質問をまとめました。SOP策定や日々の業務改善にお役立てください。
よくある質問
-
Q1. 脂肪採取部位によって幹細胞の収率や質に違いはありますか?
- はい、違いがあるという報告が多くあります。一般的に腹部や大腿部からの採取が行われますが、研究によっては大腿部の方が幹細胞の密度が高いというデータもあります。ただし、個人差や年齢の影響も大きいため、採取のしやすさや患者様の負担も考慮して部位を選定するのが一般的です。
-
Q2. 脂肪組織を輸送する際、どうしても温度逸脱が起きてしまった場合はどうすればよいですか?
- まずは逸脱した温度帯と時間を正確に把握してください。あらかじめ設定した「許容範囲(例:一時的な常温放置など)」内であれば、その根拠に基づいて受け入れを検討します。許容範囲を超えている場合は、細胞の生存率が著しく低下している可能性があるため、原則として加工中止(不適合)と判断し、医師へ報告するフローが必要です。
-
Q3. 培養中にコンタミネーション(汚染)が発生した場合の対応を教えてください。
- 直ちに該当する培養容器をインキュベーターから隔離し、廃棄します。同時に、同じインキュベーターに入っていた他の検体への影響がないかを確認し、インキュベーター内の清掃・消毒を徹底します。原因(手技ミス、培地汚染、機器不具合など)を特定し、再発防止策を講じて記録に残すことが重要です。
-
Q4. 継代数はどこまで許容されますか?
- 一般的には継代数(Passage数)が進むにつれて増殖能や分化能が低下し、細胞老化が進みます。臨床用としてはP3〜P5程度までを使用することが多いですが、施設ごとの検証データに基づいて、細胞特性が維持されている上限(限界継代数)をあらかじめ設定しておく必要があります。
-
Q5. 無菌試験の結果が出る前に出荷することは可能ですか?
- 原則として、無菌試験の結果を確認してから出荷・投与することが推奨されます。しかし、治療スケジュール等のやむを得ない事情で結果判明前に出荷する場合(迅速出荷)は、中間製品での無菌性確認や、グラム染色等の迅速試験の結果を根拠とし、医師の合意のもとでリスク管理を行いながら実施する運用も存在します。ただし、これは例外的な対応であり、厳格な手順書が必要です。