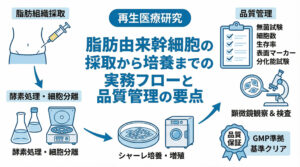
再生医療の分野において、これまでの常識を覆すような「細胞を使わない治療(セルフリー治療)」への注目が急速に高まっています。特に、間葉系幹細胞(MSC)などが分泌する細胞外小胞「エクソソーム」は、細胞移植に匹敵、あるいは凌駕する治療効果を秘めた存在として、世界中で研究競争が激化しています。
従来の幹細胞移植が抱えていた安全性や管理上の課題を克服しうる次世代のモダリティとして、エクソソームは臨床応用の段階へと着実に歩みを進めています。本記事では、医師や研究開発担当の方々に向けて、幹細胞のエクソソーム研究最前線のエビデンス、疾患別の可能性、そして実用化に向けた規制動向までを網羅的に解説いたします。これからの再生医療を牽引する鍵となる知識を、ぜひ深めてみてください。
幹細胞由来エクソソーム研究の現在地と臨床応用の結論
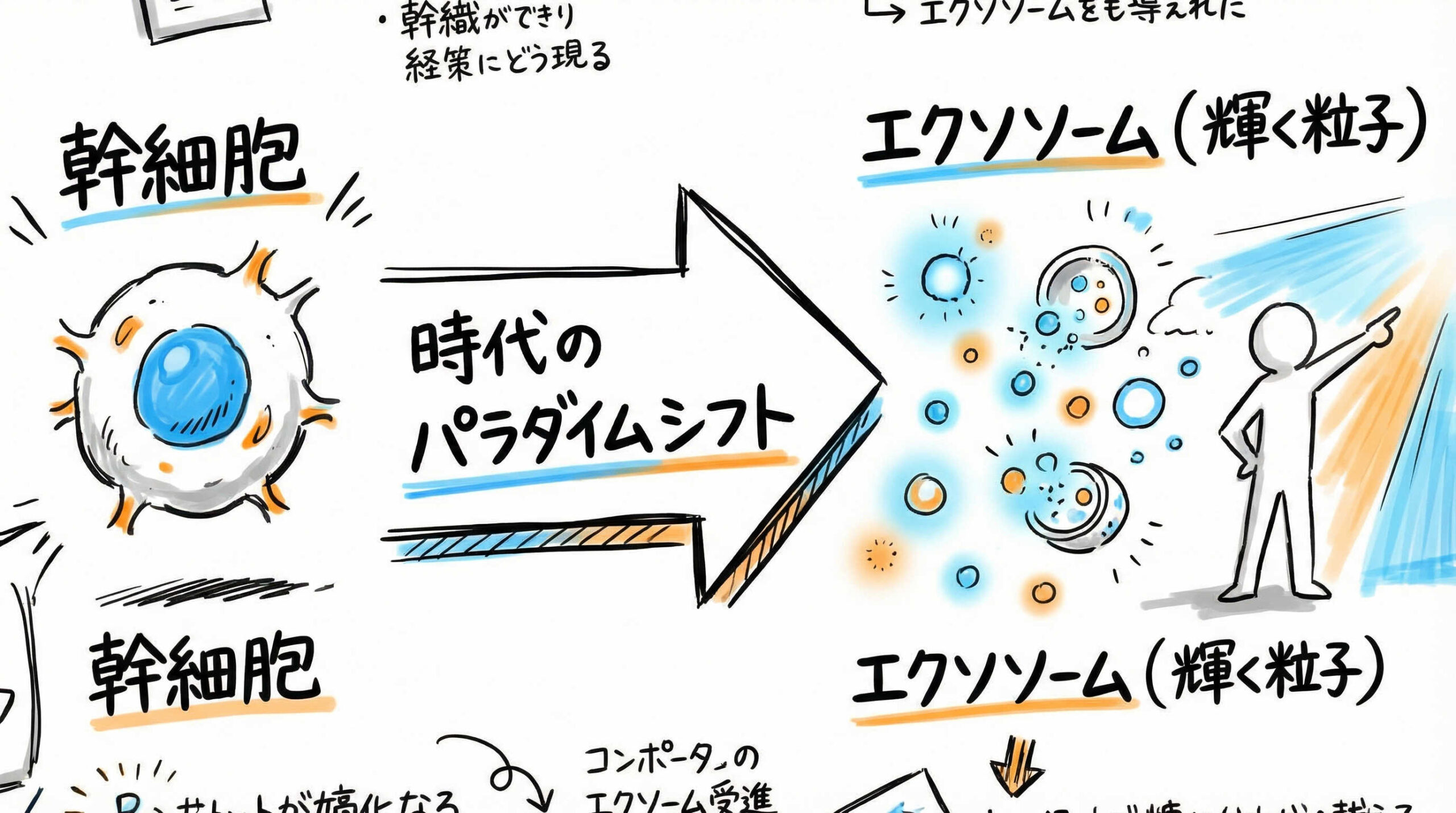
再生医療はいま、細胞そのものを移植する時代から、細胞が分泌する機能性物質を活用する時代へと大きく舵を切りつつあります。幹細胞由来エクソソームの研究は基礎段階を超え、臨床応用を見据えたトランスレーショナルリサーチが活発化しています。ここでは、現在の到達点と、なぜこれほどまでに期待されているのか、その核心に迫ります。
細胞治療からセルフリー治療(Cell-free Therapy)へのパラダイムシフト
長らく再生医療の主役は幹細胞そのものでした。しかし、移植された幹細胞が患部に定着して組織に分化する割合は極めて低いことが多くの研究で明らかになっています。現在では、幹細胞が放出する液性因子(パラクリン因子)こそが治療効果の本質であるという考え方が主流となりつつあります。
これが「セルフリー治療(Cell-free Therapy)」へのパラダイムシフトです。細胞そのものを投与しないため、生きた細胞を扱う際の複雑な管理やリスクを低減できる点が大きなメリットです。エクソソームはこのパラクリン効果の主要な担い手として再定義され、創薬ターゲットとして明確な地位を確立し始めています。
MSC(間葉系幹細胞)由来エクソソームが示す治療効果の主要エビデンス
特に間葉系幹細胞(MSC)由来のエクソソームに関しては、多岐にわたる疾患モデルでその有効性が報告されています。MSCは脂肪、臍帯、骨髄などから採取可能で、倫理的なハードルも比較的低いことから研究が進んでいます。
主要なエビデンスとしては、強力な抗炎症作用、免疫調整作用、そして血管新生の促進などが挙げられます。これらは、損傷した組織の修復環境を整える上で不可欠な要素です。例えば、炎症性サイトカインの抑制や、マクロファージの極性を炎症型(M1)から修復型(M2)へ誘導するといったメカニズムが解明されつつあり、従来の対症療法では難しかった根治的なアプローチへの道を開いています。
なぜ幹細胞移植ではなくエクソソームなのか?注目される理由と背景

「幹細胞移植で効果があるなら、わざわざエクソソームを抽出する必要があるのか?」という疑問を持たれるかもしれません。しかし、エクソソームには細胞移植にはない独自の利点と、医薬品としての開発に適した特性があります。ここでは、その注目される理由を科学的および実務的な観点から掘り下げます。
パラクリン効果の中核を担うmiRNA(マイクロRNA)とタンパク質の役割
エクソソームが単なる「細胞のゴミ」ではなく、高度な細胞間コミュニケーションツールであることが分かってきました。その脂質二重膜の内部には、親細胞由来のmiRNA(マイクロRNA)、mRNA、タンパク質などが内包されています。
特に注目すべきはmiRNAの役割です。エクソソームが標的細胞に取り込まれると、内包されたmiRNAが標的細胞の遺伝子発現を制御し、細胞死の抑制や増殖の促進といった指令を伝えます。つまり、エクソソームは生理活性物質を保護しながら届ける天然のナノカプセルとして機能しており、この精緻なメカニズムこそがパラクリン効果の中核を担っているのです。
幹細胞移植に伴う腫瘍形成リスクや免疫拒絶反応の回避
幹細胞移植における最大の懸念事項の一つに、腫瘍形成(テラトーマ形成)のリスクがあります。未分化な細胞が増殖し続ける可能性を完全に排除することは困難です。また、他家移植の場合には免疫拒絶反応のリスクも考慮しなければなりません。
一方、エクソソームは細胞核を持たないため、それ自体が自律的に増殖して腫瘍化することはありません。また、MHC(主要組織適合遺伝子複合体)の発現が低い、あるいは制御可能であるため、免疫原性が低く、拒絶反応のリスクを大幅に回避できると考えられています。この高い安全性プロファイルは、臨床応用を進める上で極めて重要なアドバンテージとなります。
医薬品としての保存安定性と輸送におけるロジスティクスの優位性
医薬品として普及させるためには、製造・流通・保管の容易さ(ロジスティクス)も無視できません。生きた細胞を用いた製剤(細胞加工物)は、厳密な温度管理や使用期限の短さが課題となり、輸送コストも高額になりがちです。
対してエクソソームは、適切な処理を行えば凍結保存が可能であり、解凍後も活性を維持しやすいという特性があります。これにより、必要な時にすぐに使用できる「オフザシェルフ(既製品)」製剤としての開発が可能になります。品質の均一性を保ちながら大量生産し、世界中へ輸送できる可能性を秘めている点は、産業的にも大きな魅力といえるでしょう。
疾患領域別に見るエクソソーム治療の研究最前線
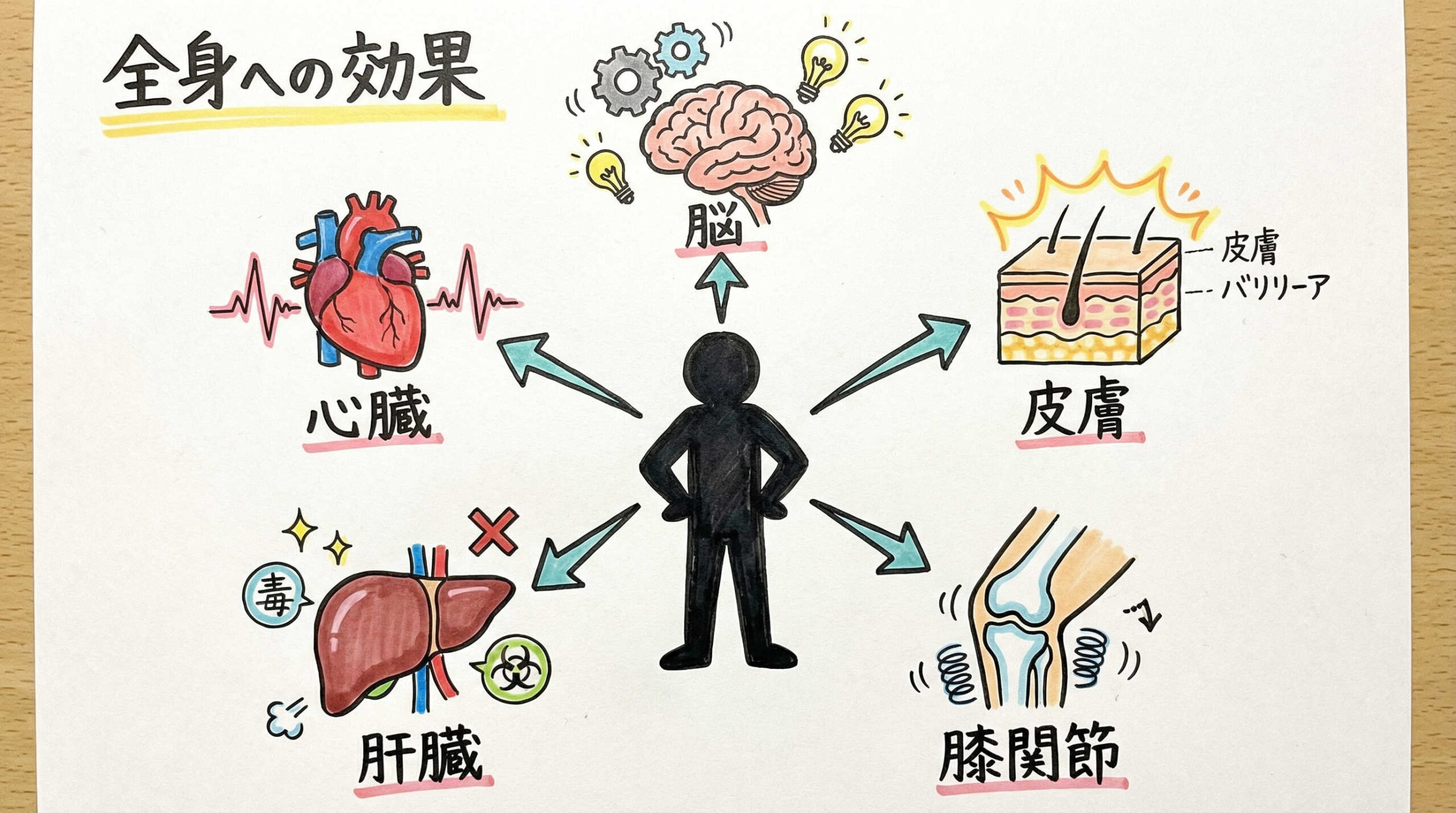
エクソソームの治療効果は全身のあらゆる臓器・組織で検証されています。特に、既存の治療法では回復が困難な難治性疾患に対して、再生医療ならではのアプローチが試みられています。ここでは、主要な5つの疾患領域における研究の最前線をご紹介します。
脳血管障害および神経変性疾患に対する神経再生アプローチ
神経領域は、エクソソーム治療への期待が最も高い分野の一つです。脳梗塞や脳出血後の機能回復、あるいはアルツハイマー型認知症やパーキンソン病といった神経変性疾患に対しての研究が進んでいます。
MSC由来エクソソームに含まれるmiRNA(miR-133bなど)が、神経突起の伸長を促進したり、神経細胞のアポトーシスを抑制したりすることが報告されています。一度失われると再生しないとされてきた神経組織に対して、神経新生を促し、機能的ネットワークの再構築を支援するデータが蓄積されつつあります。
心筋梗塞などの心血管疾患における組織修復と血管新生
心筋梗塞によって壊死した心筋細胞は自然には再生しませんが、エクソソームがその限界を突破する可能性があります。虚血再灌流障害モデルにおいて、エクソソーム投与群では心筋梗塞サイズが縮小し、心機能が改善したという報告が多数存在します。
これには、血管新生の促進による血流改善や、心筋細胞のアポトーシス抑制、さらには線維化の抑制が関与しています。カテーテル治療などの急性期治療と併用することで、予後を劇的に改善する新たな治療戦略として期待されています。
肝硬変・腎不全に対する抗炎症作用と抗線維化メカニズム
慢性的な炎症によって臓器が硬くなる「線維化」は、肝硬変や慢性腎臓病(CKD)の末期像であり、臓器移植以外に有効な治療法が乏しいのが現状です。エクソソームは、この線維化プロセスを強力にブロックする可能性を秘めています。
具体的には、線維化の主要因であるTGF-βシグナル伝達経路を阻害し、コラーゲンの過剰な蓄積を抑制する作用が確認されています。肝星細胞や腎メサンギウム細胞の活性化を抑え、炎症を沈静化させることで、臓器機能の温存を目指す研究が進められています。
呼吸器疾患(COPD・間質性肺炎)への治療応用
COVID-19パンデミック以降、呼吸器領域におけるエクソソーム研究も加速しました。急性呼吸窮迫症候群(ARDS)やCOPD(慢性閉塞性肺疾患)、間質性肺炎といった疾患がターゲットです。
肺胞上皮細胞の保護や、過剰な免疫反応(サイトカインストーム)の抑制において、エクソソームが顕著な効果を示すことが動物実験レベルで示されています。吸入療法(ネブライザー)による局所投与が可能である点も、呼吸器疾患治療における大きな利点として注目されています。
皮膚領域における創傷治癒促進と抗老化(アンチエイジング)研究
美容医療や形成外科領域では、すでに実用化に近い段階まで研究が進んでいます。エクソソームは線維芽細胞を刺激し、コラーゲンやエラスチンの産生を促進することで、シワやたるみの改善、肌のハリ向上に寄与します。
また、難治性皮膚潰瘍や熱傷の治療においても、血管新生と上皮化を促進し、創傷治癒期間を短縮させる効果が期待されています。抗老化(アンチエイジング)の観点からも、細胞レベルでの若返り効果を示唆するデータが増えており、市場の関心も非常に高い領域です。
エクソソームのDDS(ドラッグデリバリーシステム)および診断への応用
および診断への応用-1-scaled.jpg)
エクソソームの魅力は再生医療だけにとどまりません。その天然のナノ粒子としての特性を活かし、薬物を目的の場所に届ける「運び屋(キャリア)」としての利用や、病気のサインを読み取る「診断ツール」としての応用も進んでいます。
血液脳関門(BBB)を通過する薬物送達キャリアとしての開発
薬剤開発における最大の障壁の一つが、脳を異物から守る血液脳関門(BBB)の存在です。多くの薬剤はこの関門を通過できませんが、エクソソームは特定の表面タンパク質を持つことで、BBBを通過できる可能性があります。
この性質を利用し、抗がん剤や核酸医薬(siRNAなど)をエクソソームに搭載して脳腫瘍や中枢神経疾患へ届けるDDS研究が進行中です。合成リポソームと比較しても生体適合性が高く、免疫系による排除を受けにくいという利点があり、次世代の薬物送達システムとして有望視されています。
リキッドバイオプシーによるがん早期診断とバイオマーカー探索
エクソソームは、分泌元の細胞の状態を反映したメッセージ(miRNAなど)を内包しており、血液や尿などの体液中にも存在します。これらを解析することで、がんなどの疾患を早期に発見する「リキッドバイオプシー」が可能になります。
がん細胞由来のエクソソームは特異的なmiRNAパターンを持っているため、画像診断で見つからないような微細ながんの検出や、治療効果のモニタリングに役立つバイオマーカーとしての活用が期待されています。侵襲性が低く、繰り返し検査が可能である点も臨床上の大きなメリットです。
エクソソーム製剤の社会実装に向けた課題と規制動向
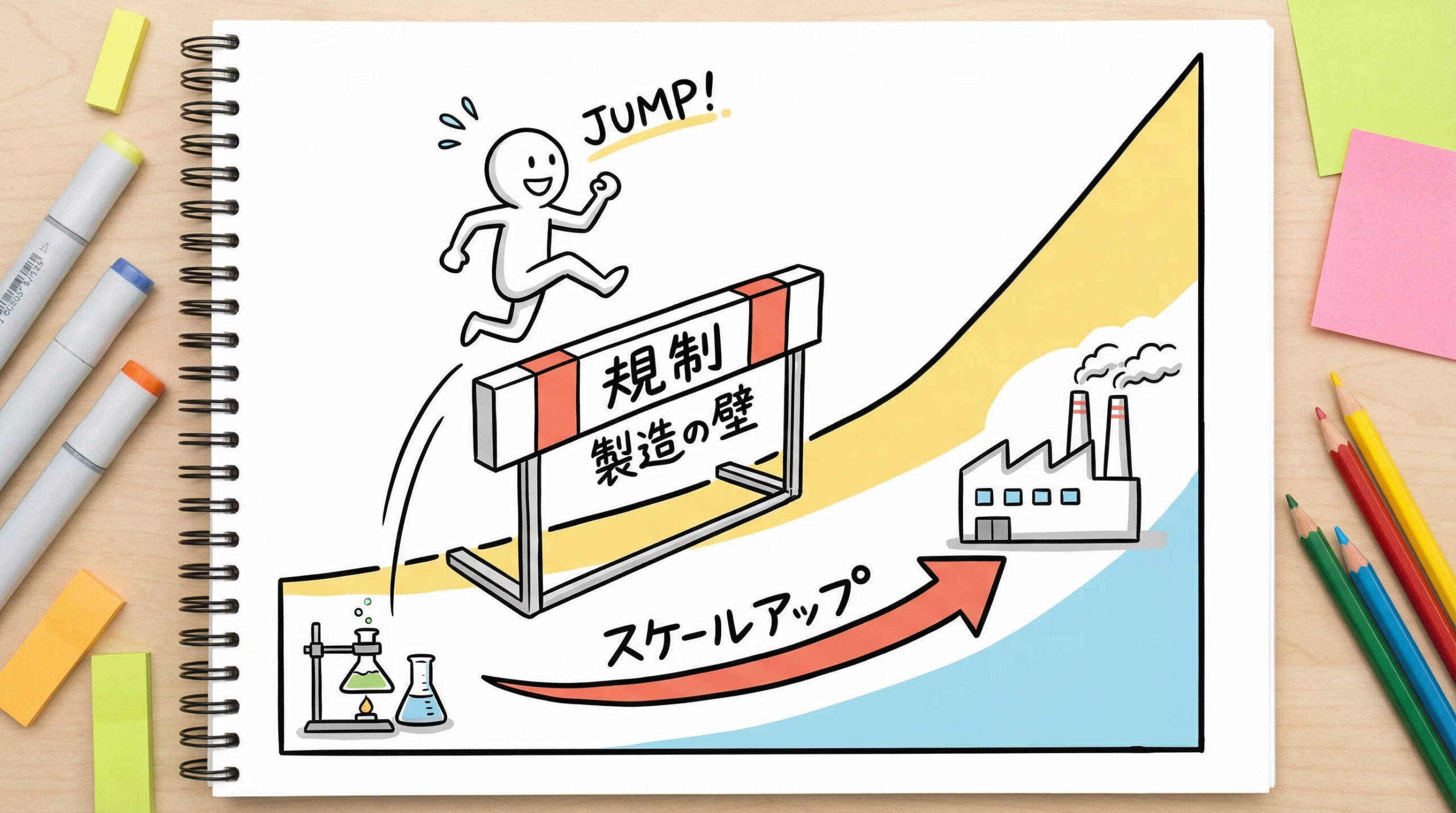
多大な可能性を秘めたエクソソームですが、医薬品として広く社会実装されるためには、乗り越えるべき技術的・制度的な壁が存在します。研究室レベルから工業レベルへのスケールアップ、そして法規制への対応など、現在進行形で議論されている課題について解説します。
臨床グレードでの大量培養と製造プロセスの確立
研究用であればフラスコ培養で十分ですが、多くの患者様に届けるためには、均質なエクソソームを大量かつ安定的に製造する必要があります。これには、3次元培養技術や大型バイオリアクターの導入が不可欠です。
しかし、培養スケールを大きくすると細胞の状態が変化し、分泌されるエクソソームの質が変わってしまうリスクがあります。「臨床グレード」を維持しながらコスト効率の良い大量培養プロセスを確立することが、製薬企業やCMO(医薬品製造受託機関)にとっての喫緊の課題となっています。
超遠心法やSEC法など分離・精製技術の標準化課題
エクソソームを培養上清から回収・精製する方法は多岐にわたりますが、標準化された「ゴールドスタンダード」はまだ確立されていません。超遠心法は純度が高いものの時間がかかり大量処理に不向きであり、サイズ排除クロマトグラフィー(SEC)法や沈殿法など、それぞれに一長一短があります。
不純物(培養液由来のタンパク質など)をどこまで除去すべきか、また回収率をどう高めるか。各社・各研究機関が独自の手法を採用している現状から、比較可能な統一基準を設ける動きが国際的にも始まっています。
エクソソームの不均一性と品質管理基準(QC)の策定
エクソソームは単一の物質ではなく、サイズや含有物が異なる小胞の集合体(ヘテロジェニアスな集団)です。この「不均一性」をどのように管理し、品質を保証するかが大きなハードルです。
ロット間差をなくすための品質管理基準(QC)として、粒子数、サイズ分布、表面マーカーの発現、タンパク質含有量などの指標が検討されています。医薬品としての承認を得るためには、常に一定の治療効果を担保できる厳格なQCシステムの策定が求められます。
再生医療等安全性確保法と医薬品医療機器等法(薬機法)上の取り扱い
日本において、エクソソーム製剤の位置づけは過渡期にあります。現在は主に自由診療の枠組みの中で、医師の裁量により「幹細胞培養上清液」として使用されるケースが見られますが、これは再生医療等安全性確保法の対象外(細胞を含まないため)とされることが多いです。
しかし、将来的には「生物学的製剤」や「再生医療等製品」に類する医薬品として、薬機法に基づいた治験・承認プロセスを経ることが本筋となります。規制当局(PMDA)とも連携しながら、安全性と有効性を科学的に証明し、正式な承認を目指す動きが加速しています。
まとめ

幹細胞由来エクソソームは、再生医療を「細胞治療」から「セルフリー治療」へと進化させる革新的なモダリティです。高い安全性、優れた組織修復能力、そして医薬品としての取り扱いやすさを兼ね備え、難治性疾患への新たな希望となっています。
- パラダイムシフト: 細胞移植の課題を克服し、パラクリン効果による治療が主流に。
- 多岐わたる応用: 神経、心血管、肝・腎、呼吸器、皮膚など広範な疾患に対応。
- 実用化への道: 大量培養や品質管理の課題はあるものの、技術革新と法整備が進んでいる。
研究最前線は日々更新されており、臨床現場への本格導入もそう遠い未来ではありません。この分野の動向を注視し続けることが、次世代の医療を切り拓く鍵となるでしょう。
幹細胞のエクソソーム研究最前線についてよくある質問

幹細胞のエクソソーム研究最前線に関して、医師や業界関係者の方からよく寄せられる質問をまとめました。