造血幹細胞移植(HSCT)は、血液悪性腫瘍や造血不全症に対する根治的治療法として確立され、長年にわたり多くの患者さんの命を救ってきました。支持療法の飛躍的な進歩や移植ソースの多様化により、かつては適応外とされた高齢者やハイリスク症例においても、安全に移植を実施できる機会が増えています。しかしながら、依然として移植片対宿主病(GVHD)や再発といった臨床的課題、さらにはドナー不足や医療経済的な負担といった社会的課題が山積しているのが現状です。
本記事では、再生医療や血液内科領域の専門家の皆様に向けて、造血幹細胞移植の現状と課題を体系的に整理いたします。最新の治療成績やトレンド、そして現場が直面するアンメットメディカルニーズを俯瞰し、今後の研究開発や事業戦略の立案にお役立ていただければ幸いです。
造血幹細胞移植(HSCT)の現状における到達点と残存する課題の全体像
の現状における到達点と残存する課題の全体像-1-scaled.jpg)
造血幹細胞移植(HSCT)の現状における到達点と残存する課題について、まずは全体像を把握しましょう。
長年の研究と臨床経験の蓄積により、移植医療は単なる「救命のための賭け」から、計算された「標準治療」へと成熟してきました。しかし、生存率の向上が見られる一方で、QOL(生活の質)を含めた真の克服には、解決すべき多面的な課題が残されています。ここでは、治療成績の向上要因と、依然として立ちはだかる障壁について概説します。
支持療法の進歩による治療成績向上と生存率の改善
近年の移植成績向上には、移植手技そのものの改善に加え、支持療法の進歩が大きく寄与しています。
強力な化学療法や放射線照射に伴う感染症リスクに対し、新規の抗真菌薬や抗ウイルス薬、G-CSF(顆粒球コロニー形成刺激因子)の適切な使用が普及しました。これにより、移植早期の治療関連死亡(TRM)は着実に減少しています。
また、輸血療法の安全性向上や、栄養管理、リハビリテーションの介入も、患者さんの全身状態維持に貢献しているといえるでしょう。これら支持療法の充実が、生存率の底上げを支える基盤となっています。
臨床現場が直面する技術的・社会的・経済的な未解決課題の要約
治療成績が向上する一方で、臨床現場は依然として多くの課題に直面しています。
技術的には、重篤なGVHDの制御や移植後再発の抑制が最大の障壁であり、これらはアンメットメディカルニーズが高い領域です。
社会的には、少子高齢化に伴うドナー不足や、ドナーコーディネートの迅速化が求められています。さらに経済的側面では、高額な新規薬剤の導入や長期フォローアップにかかるコストが、医療機関の経営や医療保険財政を圧迫する要因となっています。これらの課題は相互に関連しており、包括的な解決策の模索が必要でしょう。
国内外における造血幹細胞移植の実施トレンドと現状データ

次に、国内外における造血幹細胞移植の実施トレンドと現状のデータを詳しく見ていきましょう。
移植件数の推移やドナーソースの選択、適応年齢の拡大といった変化は、医療ニーズの変遷を如実に表しています。これらのデータは、今後の医療資源の配分や研究開発の方向性を定める上で重要な指標となるはずです。ここでは、日本造血・免疫細胞療法学会(JSHCT)などのデータに基づき、具体的なトレンドを解説します。
日本造血・免疫細胞療法学会(JSHCT)データに見る移植件数の推移
日本造血・免疫細胞療法学会(JSHCT)が毎年公表している全国調査データによると、国内の造血幹細胞移植件数は長期的には増加傾向にあります。
特に同種移植においては、適応疾患の拡大や高齢者への実施増加により、年間数千件規模で推移しています。
一方で、自家移植の件数は疾患や新規薬物療法の登場(例えば多発性骨髄腫における新規薬剤など)により変動が見られます。これらのデータは、移植医療が血液疾患治療の中で確固たる地位を占めていることを示していますが、同時に、実施施設への負荷が増大している現状も浮き彫りにしています。
末梢血幹細胞・骨髄・さい帯血など移植ソースの選択傾向の変化
移植ソース(幹細胞源)の選択においても、明確なトレンドの変化が見受けられます。
かつて主流であった骨髄移植に加え、末梢血幹細胞移植(PBSCT)の割合が増加しています。PBSCTは採取の負担が比較的少なく、生着が早いというメリットがあるためです。
また、日本は世界的に見てもさい帯血移植の実施件数が多い国であり、適切なドナーが見つからない場合の代替ソースとして重要な役割を果たしています。患者さんの病状や緊急度、ドナーの背景に合わせて、最適なソースを選択する戦略が定着してきました。
強度減弱前処置(RIC)の確立による高齢者への適応拡大
強度減弱前処置(RIC:Reduced Intensity Conditioning)、いわゆる「ミニ移植」の確立は、移植医療における大きなパラダイムシフトでした。
従来の前処置に耐えられない高齢者や臓器障害を持つ患者さんに対しても、免疫学的効果(GVL効果)による治癒を目指すことが可能になりました。
この技術革新により、移植の適応年齢の上限は事実上撤廃されつつあり、70歳以上の患者さんへの実施例も珍しくありません。高齢化社会である日本において、RICの普及は移植医療の裾野を大きく広げたといえるでしょう。
HLA半合致移植(ハプロ移植)の技術確立と普及状況
近年、HLA半合致移植(ハプロ移植)が急速に普及しています。
これは、HLAが半分しか適合しない親子や兄弟間で行う移植法です。以前は激しいGVHDが問題視されていましたが、移植後シクロホスファミド(PT-Cy)法などのGVHD予防法の確立により、安全性が飛躍的に向上しました。
ハプロ移植の最大の利点は、ドナーが家族内に見つかる可能性が高く、迅速に移植を実施できる点です。緊急を要する症例や、バンクドナーが見つからない場合の有力な選択肢として、その地位を確立しつつあります。
移植成績向上を阻む臨床的課題とアンメットメディカルニーズ
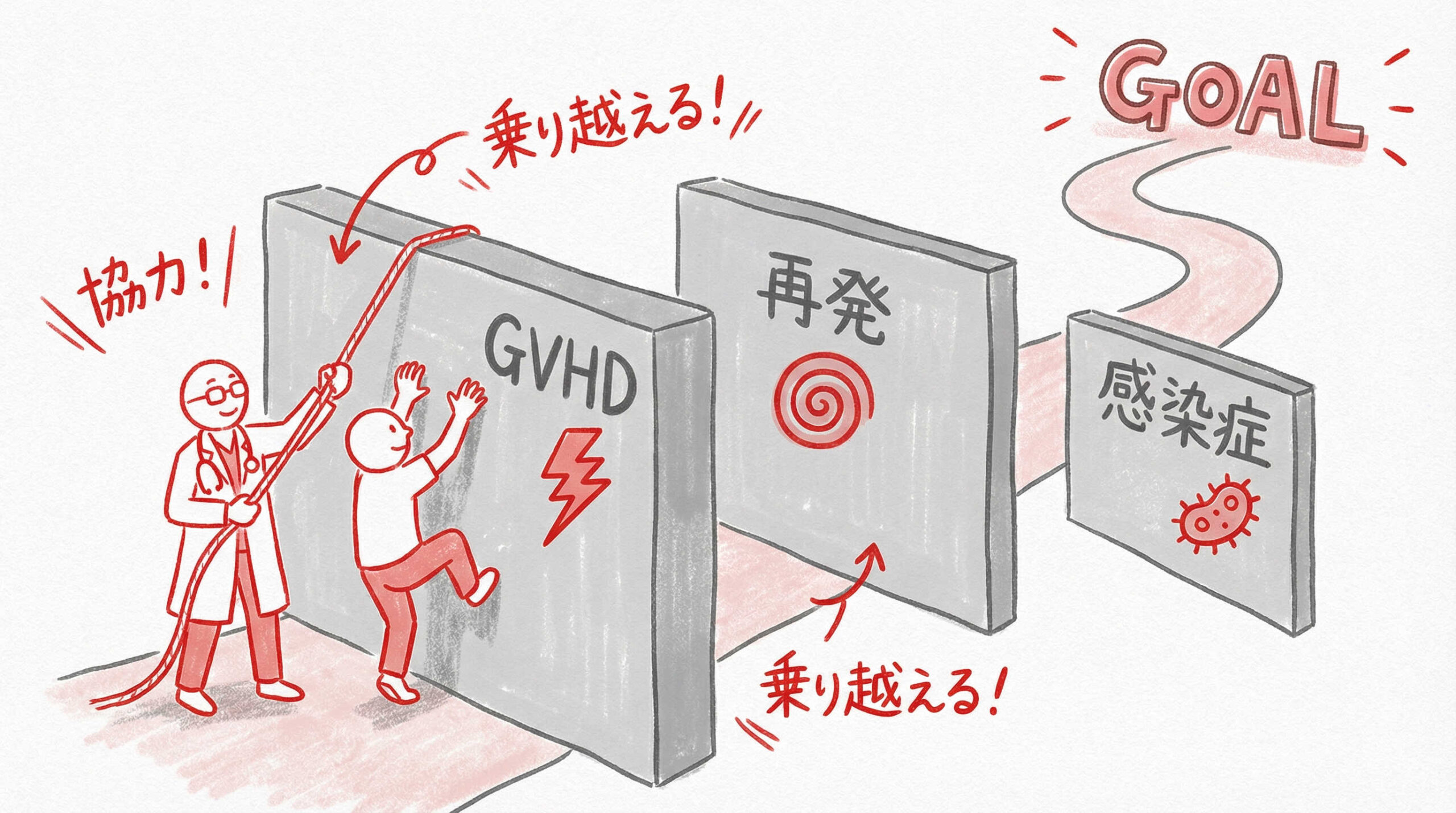
移植技術が成熟した現在でも、成績向上を阻む臨床的課題は依然として存在します。
特に、移植関連死の主要因となる合併症や、原疾患の再発は、患者さんの予後を大きく左右する重大な問題です。ここでは、臨床現場で特に解決が待たれるアンメットメディカルニーズ、すなわちGVHD、再発、感染症、そして晩期合併症への対策について詳述します。
急性・慢性GVHD(移植片対宿主病)の予防戦略と制御困難例への対応
GVHD(移植片対宿主病)は、移植医療の成功を左右する最大の敵といっても過言ではありません。
急性GVHDに対しては、ステロイドパルス療法が第一選択となりますが、ステロイド抵抗性の難治例に対する治療選択肢は限られていました。近年、JAK阻害剤などの新規薬剤が登場し、治療成績の改善が期待されています。
慢性GVHDにおいては、長期的なQOL低下が課題です。皮膚や肺、眼などの多臓器にわたる症状に対し、免疫抑制剤の調整だけでなく、リハビリテーションや局所療法を含めた集学的アプローチが求められています。
移植後再発に対する治療オプションの限界と新規薬剤への期待
移植後の再発は、極めて予後不良な転帰をたどることが多く、治療オプションの限界が指摘されています。
ドナーリンパ球輸注(DLI)は有効な手段の一つですが、GVHDのリスクを伴います。そのため、再発予防としての維持療法や、再発後の新規分子標的薬の導入に期待が寄せられています。
FLT3阻害剤やBCL-2阻害剤など、特定の遺伝子変異や分子メカニズムを標的とした薬剤を移植後早期から使用することで、再発率を低減させる試みが進められています。これら新規薬剤と移植の最適な組み合わせの確立が急務です。
サイトメガロウイルス(CMV)等の日和見感染症管理
免疫抑制状態にある移植患者さんにとって、サイトメガロウイルス(CMV)などの日和見感染症は致死的となり得ます。
かつてはCMV肺炎による死亡率が高かったものの、抗ウイルス薬の予防投与や先制治療の普及により、コントロールは改善してきました。
特に、レテルモビルなどの新規抗CMV薬の登場は、骨髄抑制などの副作用を抑えつつCMV再活性化を予防することを可能にしました。しかし、薬剤耐性ウイルスの出現や、その他のウイルス(EBV、アデノウイルスなど)への対応など、感染症管理における課題は依然として残されています。
二次がんリスクや妊孕性温存を含む晩期合併症対策
移植サバイバーが増加するにつれ、晩期合併症対策の重要性が増しています。
放射線や化学療法の影響による二次発がんリスクや、内分泌障害、代謝異常など、長期的な健康管理が必要です。
特に、若年患者さんにおける妊孕性(妊娠する力)の温存は、治療後の人生設計に関わる切実な問題です。移植前の精子・卵子凍結保存などの生殖医療との連携が不可欠であり、患者さんが治療後の未来に希望を持てるような包括的なサポート体制の構築が求められています。
ドナー確保システムと提供体制における社会的課題
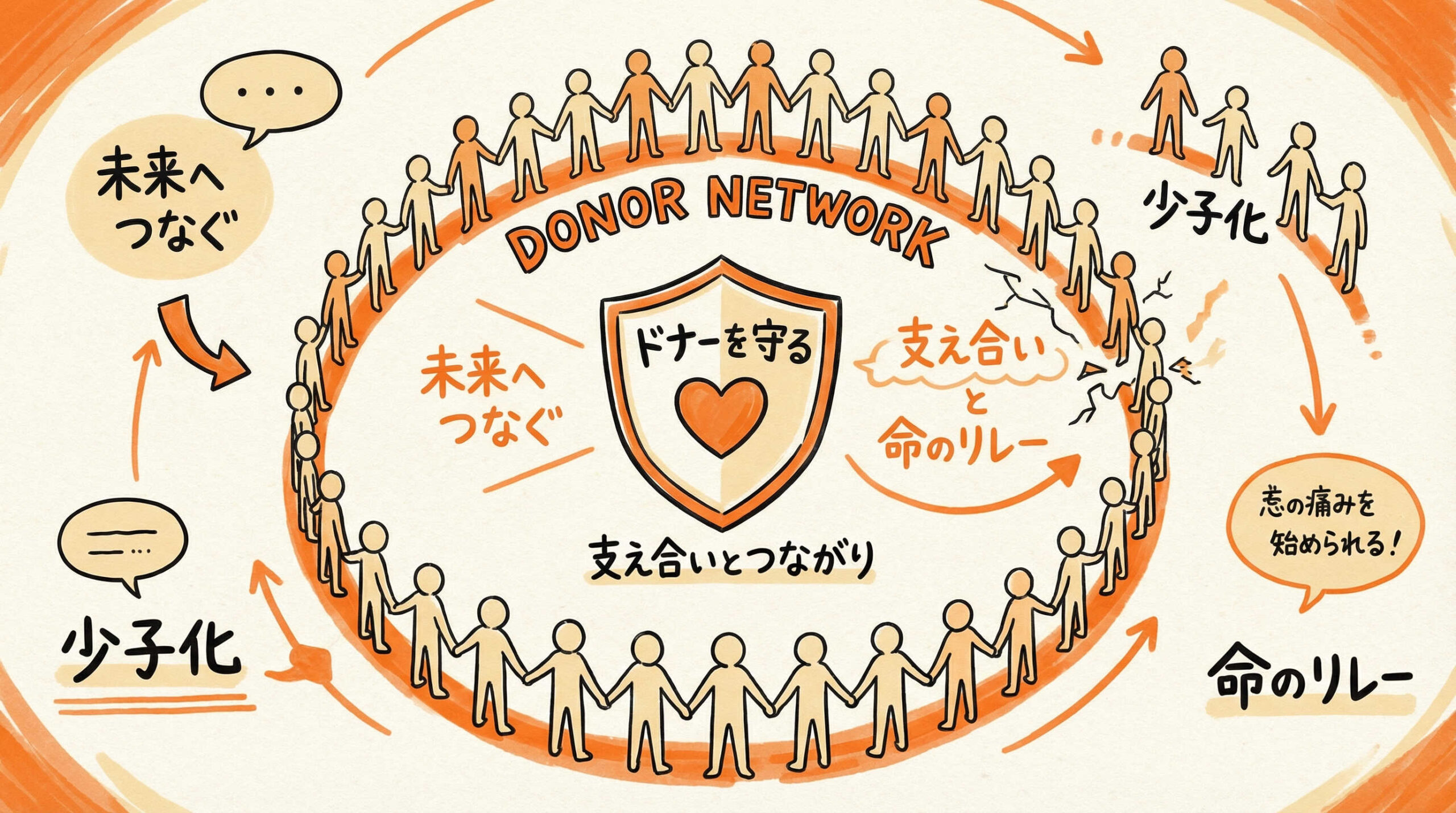
移植医療を支える根幹である「ドナー」の確保システムにも、社会的・構造的な課題が生じています。
少子高齢化が進む日本において、ドナープールの維持と適正化は喫緊の課題です。また、ドナー自身の安全と権利を守ることも、移植医療の持続可能性を担保する上で欠かせません。ここでは、ドナー提供体制における現状の問題点と対策について解説します。
非血縁ドナーコーディネート期間の短縮と緊急移植への対応
非血縁者間移植において、ドナー選定から移植実施までの期間(コーディネート期間)の長さは、病状の進行が早い患者さんにとって致命的になりかねません。
骨髄バンクでは、登録から採取までに数ヶ月を要することが一般的です。
このタイムラグを短縮するために、コーディネートプロセスの効率化が進められています。一方で、緊急を要する場合には、コーディネート期間が短いさい帯血移植や、家族間ハプロ移植が選択される傾向にあります。患者さんの病状と時間的猶予を見極めた、柔軟なドナー選択戦略が重要です。
骨髄バンク・さい帯血バンクにおけるドナーの高齢化問題
骨髄バンクやさい帯血バンクにおけるドナー登録者の高齢化は、深刻な問題となりつつあります。
日本の人口構造上、若年層のドナー登録者数が伸び悩んでおり、長期的には適格なドナーが不足する懸念があります。
移植成績はドナーの年齢が若いほど良好であるというデータもあり、若年層への啓発活動や登録推進が不可欠です。SNSを活用した広報や、大学・企業での登録会の実施など、新たな層にアプローチする取り組みが強化されています。
ドナーの安全性確保と心理的・身体的負担の軽減策
善意で提供を行うドナーの安全性確保は、移植医療の絶対条件です。
末梢血幹細胞採取におけるG-CSF投与の安全性や、骨髄採取に伴う全身麻酔のリスクについて、十分な説明と医学的管理が求められます。
また、身体的負担だけでなく、ドナーが感じる心理的な不安や、仕事・学業への影響(休業補償など)に対するサポートも重要です。ドナーが安心して提供できる環境を整備することは、社会全体で移植医療を支える基盤となります。ドナー休暇制度の普及などもその一環といえるでしょう。
移植医療の持続可能性に関わる医療経済・制度的課題
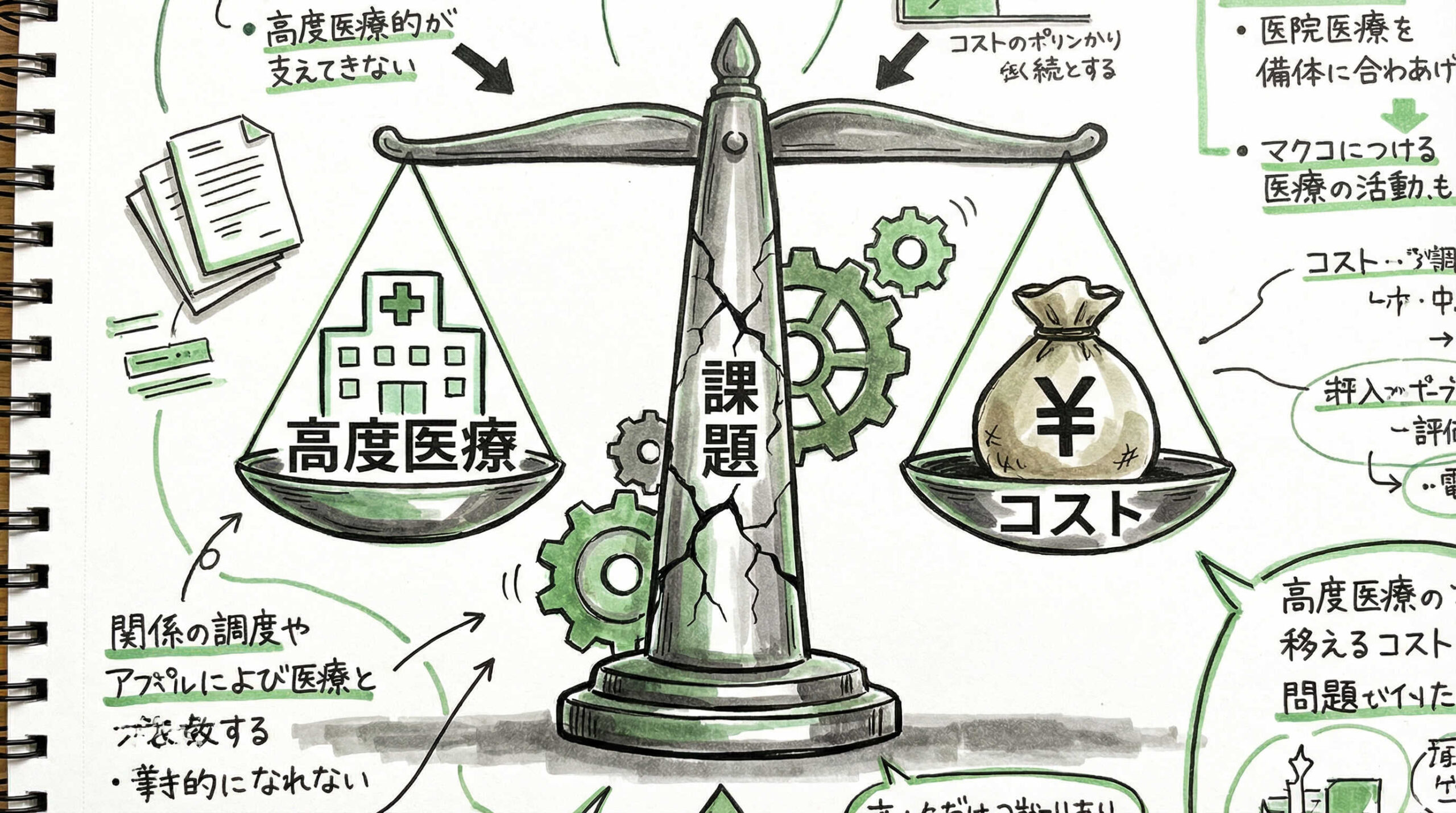
高度な医療技術である造血幹細胞移植は、医療経済や制度の面でも多くの課題を抱えています。
高額な医療費、専門職の不足、地域格差などは、移植医療を持続可能なものにするために解決しなければならない構造的な問題です。ここでは、病院経営や医療提供体制に関わる現実的な課題に焦点を当てます。
高額薬剤の使用とDPC/PDPS制度における病院経営へのインパクト
移植医療には高額な薬剤や機材が必要となりますが、DPC/PDPS(診断群分類包括評価)制度下では、出来高算定できない部分が病院経営を圧迫することがあります。
特に、新規の高額薬剤や未承認薬を使用する場合、病院側の持ち出しとなるケースも少なくありません。
適切な医療を提供しつつ、病院経営の健全性を維持することは容易ではありません。学会等を通じて、診療報酬の適正化や高額薬剤の別枠算定などを働きかけていく必要があります。経済的な理由で最適な治療が制限されることは避けなければなりません。
長期フォローアップ(LTFU)体制の地域格差と病診連携の不足
移植後の患者さんは、長期にわたる定期的なフォローアップ(LTFU)が必要です。
しかし、移植実施施設(拠点病院)への通院は、遠方の患者さんにとって大きな負担となります。一方で、地域の医療機関では移植後の専門的な管理が難しいという現状があります。
このギャップを埋めるためには、「病診連携」の強化が不可欠です。拠点病院と地域のかかりつけ医が情報を共有し、役割分担を行うことで、患者さんが地域で安心して生活できる体制づくりが求められています。しかし、その連携体制には地域格差があるのが実情です。
移植コーディネーター(HCTC)および専門医のマンパワー不足
移植医療は多職種によるチーム医療ですが、それを支える専門職のマンパワー不足が慢性化しています。
特に、ドナー調整や患者支援を行う造血細胞移植コーディネーター(HCTC)の業務量は増大しており、人員配置が追いついていない施設も多いでしょう。
また、高度な専門知識を持つ移植専門医の育成も急務です。過酷な勤務環境や訴訟リスクなどから、若手医師が敬遠する傾向も懸念されます。持続可能な医療体制を維持するために、働き方改革を含めた人材確保・育成の戦略が必要です。
新規モダリティの台頭による移植医療の今後の展望
最後に、新規モダリティの台頭による移植医療の未来について展望します。
CAR-T療法に代表される免疫細胞療法や、ゲノム編集技術の進歩は、従来の造血幹細胞移植のあり方を大きく変えようとしています。これらは競合するものではなく、相互に補完し合う新たな治療戦略として統合されていくことでしょう。
CAR-T療法等の免疫細胞療法とHSCTの治療シークエンス
CAR-T療法などの遺伝子改変T細胞療法は、再発・難治性の血液がんに対して劇的な効果を示しています。
これにより、一部の症例では同種移植を回避できる可能性が出てきました。しかし、現時点ではすべての症例で根治が得られるわけではなく、CAR-T療法後に同種移植を行う「ブリッジ治療」としての役割も重要視されています。
今後は、どのタイミングでどちらの治療を選択すべきか、あるいはどのように組み合わせるべきかという「治療シークエンス」の最適化が、臨床研究の主要なテーマとなっていくでしょう。
ゲノム編集技術等を応用した次世代造血幹細胞移植の可能性
ゲノム編集技術を応用した次世代の造血幹細胞移植も、現実のものとなりつつあります。
海外では、鎌状赤血球症やサラセミアに対して、患者さん自身の造血幹細胞をゲノム編集して戻す遺伝子治療が承認されています。これにより、GVHDのリスクがない自家移植で根治を目指すことが可能になります。
日本においても、こうした技術の臨床応用が期待されています。オフターゲット効果などの安全性への懸念を払拭しつつ、難治性疾患に対する新たな治療選択肢として確立される日が待たれます。
まとめ

造血幹細胞移植は、支持療法の進歩やRICの普及、ハプロ移植の確立により、より多くの患者さんに適用可能な標準治療へと進化を遂げました。しかし、GVHDや再発といった臨床的課題、ドナー不足や医療経済的な問題など、解決すべきハードルは依然として高く存在しています。
今後は、新規薬剤やCAR-T療法、ゲノム編集技術といった新たなモダリティとの融合により、治療成績のさらなる向上が期待されます。同時に、ドナー支援やLTFU体制の整備など、社会的な基盤強化も不可欠です。医療従事者、研究者、そして社会全体が連携し、これらの課題に一つひとつ取り組んでいくことが、移植医療の未来を切り拓く鍵となるでしょう。
造血幹細胞移植の現状と課題についてよくある質問

以下に、造血幹細胞移植の現状と課題に関して、専門家や関係者からよく寄せられる質問をまとめました。
-
高齢者に対する造血幹細胞移植の適応年齢の上限はありますか?
- 明確な年齢制限はありませんが、強度減弱前処置(RIC)の普及により、70歳以上の患者さんでも全身状態(PS)や臓器機能が良好であれば実施されるケースが増えています。年齢だけでなく、生理学的年齢や併存疾患を総合的に評価して判断します。
-
ハプロ移植とさい帯血移植はどのように使い分けられていますか?
- 主に緊急性とドナーの有無で判断されます。ハプロ移植は家族内にドナーが見つかりやすく迅速に実施可能ですが、さい帯血移植はドナー候補がいない場合の即時利用可能なソースとして有用です。施設の経験や患者さんの病状に合わせて選択されます。
-
移植後のQOL向上のための長期フォローアップ(LTFU)の役割とは?
- LTFUは、GVHDや二次がん、代謝異常などの晩期合併症を早期に発見・管理するだけでなく、心理社会的支援を通じて患者さんの社会復帰をサポートする重要な役割を担っています。
-
CAR-T療法が登場しましたが、同種移植の件数は減るのでしょうか?
- 一部の疾患や病状では代替される可能性がありますが、CAR-T療法後の再発例に対する救済や、CAR-T適応外の症例において、同種移植の役割は依然として重要です。今後は両者の適切な治療シークエンスが模索されていくでしょう。
-
移植医療におけるDPC制度の課題とは何ですか?
- 移植医療では高額な新規薬剤や支持療法薬が必要となることが多いですが、DPC(包括払い)制度下ではそれらのコストが十分にカバーされず、病院経営を圧迫する構造的な問題があります。これにより、最適な治療選択が経済的に困難になる懸念があります。