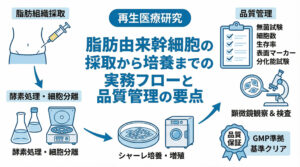
再生医療の分野において、間葉系幹細胞(MSC)はその多面的な機能と高い安全性から、最も臨床応用が期待されている細胞ソースの一つです。
従来の「失われた組織を補う」という概念を超え、現在では免疫調節能や栄養因子の放出によるパラクライン効果など、多様な作用機序が解明されつつあります。
これにより、難治性疾患に対する新たな治療戦略として、多くの医師や研究者がMSCの可能性に注目しています。
本記事では、MSCの基礎的な定義や生物学的特性から、最新の臨床研究に基づくエビデンス、そして実用化に向けた課題までを体系的に解説します。
新規プロジェクトの立ち上げや臨床研究の計画において、確かな判断材料となる情報を提供いたしますので、ぜひ実務にお役立てください。
間葉系幹細胞(MSC)の定義と再生医療における臨床的有用性
の定義と再生医療における臨床的有用性-1-scaled.jpg)
再生医療の中核を担う細胞として、間葉系幹細胞(MSC)の定義とその臨床的有用性を正しく理解することは極めて重要です。ここでは、国際的な基準や他の幹細胞との比較を通じて、なぜMSCが臨床現場で広く選択されているのか、その背景にある科学的根拠を整理していきましょう。
国際細胞治療学会(ISCT)が定めるMSCの3つの最低基準
MSCの研究や臨床応用において、世界共通の言語として機能しているのが国際細胞治療学会(ISCT)による定義です。2006年に提唱されたこのミニマムクライテリアは、MSCを同定するための必須条件となっています。
具体的には、以下の3つの基準を満たす必要があります。
- 標準的な培養条件下でのプラスチック付着性を持つこと
- 特定の表面抗原の発現パターンを示すこと(CD105、CD73、CD90が陽性であり、かつCD45、CD34、CD14またはCD11b、CD79aまたはCD19、HLA-DRが陰性であること)
- in vitroにおける3系統(骨芽細胞、脂肪細胞、軟骨細胞)への分化能を有すること
これらの基準は、研究間での再現性を確保し、品質管理を行う上での基礎となります。ただし、近年では組織由来による特性の違いも指摘されており、これらに加えて機能的な評価を行うことが推奨されています。
体性幹細胞の中でのMSCの位置づけと他幹細胞との比較
再生医療に用いられる幹細胞には、ES細胞やiPS細胞といった多能性幹細胞と、MSCを含む体性幹細胞が存在します。MSCは体性幹細胞の一種であり、成体の様々な組織に存在しています。
ES細胞やiPS細胞と比較した際、MSCの最大の特徴はその取り扱いの容易さと倫理的なハードルの低さにあります。
- 腫瘍形成リスク: 多能性幹細胞に比べて低く、安全性が高い
- 倫理的問題: 受精卵を使用せず、患者本人やドナーの組織から採取可能
- 培養技術: 特殊な技術を要さず、比較的容易に増殖させることができる
造血幹細胞などが分化能が限定的であるのに対し、MSCは中胚葉系組織への分化能に加え、幅広いパラクライン効果を持つ点で、治療用細胞としての汎用性が高いと言えるでしょう。
臨床応用においてMSCが第一選択となり得る科学的根拠
臨床現場においてMSCが第一選択となり得る理由は、単に採取が容易であるという点にとどまりません。その科学的根拠は、MSCが持つユニークな生物学的特性に支えられています。
特に注目すべきは、免疫原性の低さと免疫調節能です。MSCはMHCクラスIIの発現が低く、他家移植(同種移植)においても拒絶反応が起きにくいという特性があります。これにより、細胞バンクの構築や即納可能な製剤としての開発が可能となります。
また、炎症部位に集積し、過剰な免疫反応を抑制する能力は、GVHD(移植片対宿主病)や自己免疫疾患の治療において強力な武器となります。このように、安全性と有効性のバランスが優れている点が、MSCが多くの臨床試験で採用される主要な理由です。
臨床効果を支えるMSCの生物学的特性と詳細な作用機序
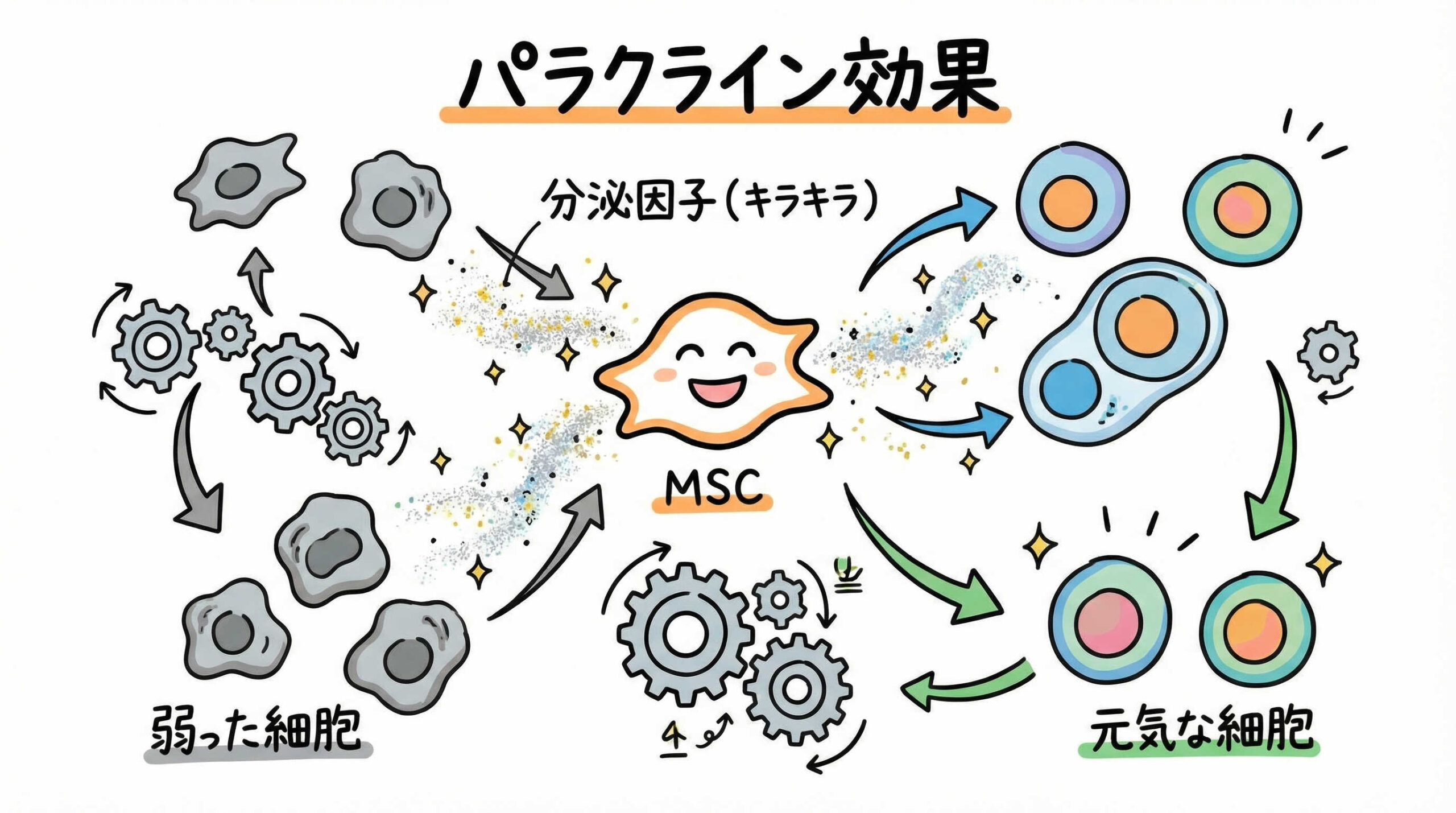
MSCが臨床効果を発揮するメカニズムは、単一の作用ではなく、複数の生物学的プロセスが複合的に関与しています。かつては分化による組織置換が主と考えられていましたが、現在では分泌因子や細胞間相互作用が重要視されています。ここでは、その詳細な作用機序について解説します。
組織特異的細胞への分化能による直接的な組織修復
MSCの最も基本的な特性として知られているのが、組織特異的細胞への分化能です。損傷した組織において、MSCが骨、軟骨、筋肉、脂肪などの細胞に直接分化し、欠損部を補填するというメカニズムです。
例えば、骨欠損部においてMSCが骨芽細胞へ分化し、新生骨の形成を促進するプロセスなどがこれに該当します。しかしながら、近年の研究では、投与されたMSCが長期間生着し、組織そのものに置き換わる割合は必ずしも高くないことが示唆されています。
現在では、この直接的な分化能はMSCの機能の一部であり、後述するパラクライン効果などと協調して組織修復に寄与していると考えられています。
T細胞やマクロファージに対する免疫調節能と抗炎症作用
現在のMSC治療において、最も臨床的意義が大きいと考えられているのが免疫調節能です。MSCは、活性化したT細胞の増殖を抑制し、炎症性マクロファージ(M1型)から抗炎症性マクロファージ(M2型)への極性転換を誘導します。
この作用は、PGE2(プロスタグランジンE2)、IDO(インドールアミン2,3-ジオキシゲナーゼ)、TGF-βなどの液性因子を介して行われます。
過剰な炎症反応を鎮静化させるこの能力は、組織損傷の拡大を防ぐだけでなく、自己免疫疾患やアレルギー疾患、さらにはCOVID-19に伴うサイトカインストームの制御など、幅広い疾患への応用が期待される根拠となっています。
損傷組織へ特異的に集積するホーミング効果(遊走能)
MSCには、損傷や炎症が起きている部位を感知し、その場所へ遊走して集積する「ホーミング効果」が備わっています。これは、損傷組織から放出されるケモカインやサイトカインの濃度勾配をMSCが認識することで起こります。
静脈内投与されたMSCが、血流に乗って全身を巡りながら、治療が必要な患部へ自律的に到達できるのはこのためです。
- SDF-1/CXCR4軸: ホーミングに関与する代表的なシグナル経路
- 接着因子の発現: 血管内皮細胞への接着を介して組織内へ浸潤
このドラッグデリバリーシステムのような特性により、全身投与であっても局所的な治療効果を発揮することが可能となります。
栄養因子およびエクソソーム放出によるパラクライン効果
MSCが「生きた薬工場」と形容される所以は、その強力なパラクライン効果にあります。MSCは、血管新生因子(VEGF)、肝細胞増殖因子(HGF)、神経栄養因子(BDNF)など、多種多様な生理活性物質を周囲に放出します。
さらに近年注目されているのが、エクソソーム(細胞外小胞)の役割です。MSC由来のエクソソームには、miRNAやタンパク質が内包されており、これが近隣の細胞に取り込まれることで、細胞死の抑制や再生能力の活性化を誘導します。
細胞そのものを移植せずとも、この分泌成分だけで治療効果が得られる可能性もあり、セルフリー治療(Cell-free therapy)としての研究も進展しています。
ミトコンドリア転送による標的細胞の代謝活性化メカニズム
比較的新しい概念として注目されているのが、MSCによる「ミトコンドリア転送」です。機能不全に陥った組織細胞に対して、MSCが自身の健全なミトコンドリアをトンネルナノチューブ(TNT)やマイクロベシクルを介して受け渡す現象が確認されています。
これにより、損傷細胞の好気的呼吸が回復し、ATP産生能が向上することで、細胞死(アポトーシス)が回避されます。
急性肺障害や心筋梗塞などの虚血再灌流障害において、このエネルギー代謝のレスキュー機構が重要な保護作用を果たしていることが明らかになりつつあり、MSCの多機能性を象徴するメカニズムの一つと言えるでしょう。
細胞起源(ソース)による特性の違いと臨床研究における使い分け
による特性の違いと臨床研究における使い分け-1-scaled.jpg)
「間葉系幹細胞」と一口に言っても、採取する組織(ソース)によってその特性には差異があります。対象とする疾患や治療目的に応じて最適なソースを選択することが、臨床研究の成功には不可欠です。主要なソースごとの特徴を見ていきましょう。
骨髄由来間葉系幹細胞(BM-MSC)の確立されたエビデンスと課題
骨髄由来間葉系幹細胞(BM-MSC)は、最も古くから研究されており、多くの臨床データが蓄積されている「ゴールドスタンダード」とも言える存在です。骨分化能や軟骨分化能に優れており、整形外科領域での実績が豊富です。
しかし、採取にあたって全身麻酔や穿刺が必要であり、ドナーへの侵襲性が高いという課題があります。また、ドナーの年齢とともに細胞の増殖能や分化能が低下する傾向があり、高齢患者からの自家移植の場合、十分な品質の細胞数を確保するのが難しいケースも存在します。
脂肪由来間葉系幹細胞(ADSC)の採取低侵襲性と高い増殖能
脂肪由来間葉系幹細胞(ADSC)は、皮下脂肪組織から採取できるため、BM-MSCに比べて採取時の侵襲が少なく、美容外科手術の副産物として大量に入手することも可能です。
特筆すべきは、高い増殖能力と採取できる細胞数の多さです。骨髄と比較して、同量の組織から得られるMSCの数が格段に多いため、培養期間を短縮できるメリットがあります。
免疫調節能も高く、自己免疫疾患や創傷治癒への応用が進んでいますが、骨分化能に関してはBM-MSCに一歩譲るとの報告もあります。自家移植のソースとして非常に扱いやすい細胞です。
臍帯由来間葉系幹細胞(UC-MSC)の低い免疫原性と細胞供給力
臍帯(へその緒)由来間葉系幹細胞(UC-MSC)は、出産時に廃棄される組織を利用するため、ドナーへの侵襲が全くなく、倫理的な問題も少ないのが特徴です。
最大の利点は、細胞が若く、増殖能や未分化性が極めて高いことです。また、免疫原性が他のソースよりもさらに低いため、他家移植(同種移植)用の細胞製剤としての開発に最も適しています。
均質な細胞を大量に製造できるポテンシャルがあり、現在、多くの製薬企業がUC-MSCを用いた既製品としての再生医療等製品の開発に注力しています。
歯髄・滑膜由来などその他のソースにおける特性比較
上記以外にも、歯髄(Dental Pulp)や滑膜(Synovium)由来のMSCが注目されています。
- 歯髄由来MSC: 乳歯や親知らずから採取可能。神経堤由来の細胞を含むため、神経再生能力に優れているとされ、脊髄損傷や脳梗塞への応用が期待されています。
- 滑膜由来MSC: 関節内にある組織由来であり、特に軟骨分化能が高いことが知られています。半月板損傷や軟骨欠損の治療において、組織適合性の観点から有利と考えられています。
このように、治療したい組織と親和性の高いソースを選ぶ「適材適所」の考え方が広まっています。
MSCを用いた臨床応用の現状と主要疾患領域のエビデンス
基礎研究で示された可能性は、着実に臨床現場へと還元されつつあります。すでに承認された製品から、現在進行中の治験まで、MSCの臨床応用は多岐にわたります。ここでは主要な疾患領域ごとのエビデンスを紹介します。
ステロイド抵抗性移植片対宿主病(GVHD)に対する免疫制御
造血幹細胞移植後の重篤な合併症である移植片対宿主病(GVHD)、特にステロイド治療が効かない難治性の症例に対して、MSCは画期的な治療選択肢となっています。
日本国内でも、ヒト骨髄由来MSCを用いた製品(テムセルHS注)が承認されており、保険適用されています。MSCが持つ強力な免疫抑制作用が、ドナー由来のリンパ球による攻撃を沈静化させ、症状を改善します。
これはMSCの「免疫調節薬」としての側面が臨床的に証明された最初の成功例であり、他の免疫疾患への応用を後押しする重要なエビデンスとなっています。
変形性関節症および軟骨欠損などの整形外科領域での応用
整形外科領域では、変形性膝関節症や外傷性軟骨欠損に対する治療研究が盛んです。関節内へのMSC注射は、抗炎症作用による疼痛緩和と、組織修復の促進を目的として行われます。
多くの臨床試験において、痛みの軽減や関節機能の改善が報告されており、一部では軟骨の再生を示唆する画像所見も得られています。特に、滑膜由来や脂肪由来のMSCを用いた治療は、人工関節置換術を回避したい患者さんにとって、保存療法と手術療法の間を埋める新たな選択肢として期待されています。
脊髄損傷・脳梗塞後遺症に対する神経再生アプローチ
一度損傷すると再生しないとされてきた中枢神経系においても、MSCの可能性が探求されています。脊髄損傷においては、受傷後の急性期から亜急性期にMSCを投与することで、神経栄養因子の供給や炎症抑制、さらには神経回路の再構築を促す効果が期待されています。
実際に、脊髄損傷患者に対して自身の骨髄由来MSCを静脈内投与する治療法(ステミラック注)が条件付き早期承認制度下で承認されています。また、脳梗塞後遺症に対しても、機能回復を目指した臨床試験が複数進行しており、リハビリテーションとの併用効果が注目されています。
肝硬変や慢性腎臓病など臓器線維化疾患への治療戦略
肝硬変や慢性腎臓病といった、臓器が線維化し機能不全に陥る疾患に対してもMSCは有効性を示しています。MSCは、線維化の原因となる筋線維芽細胞の活性を抑制し、コラーゲンの分解を促進する作用(抗線維化作用)を持っています。
肝硬変患者への投与では、肝機能の改善や腹水の減少といった効果が報告されています。不可逆的と考えられていた線維化組織に対して、組織環境を改善し、残存する細胞の再生を助けるアプローチは、臓器移植のドナー不足問題を緩和する一手となるかもしれません。
クローン病などの炎症性腸疾患(IBD)に対する臨床成績
クローン病や潰瘍性大腸炎などの炎症性腸疾患(IBD)は、若年者に多く見られる難治性疾患です。特にクローン病に伴う複雑痔瘻(じろう)に対して、脂肪由来MSCを用いた局所注射製剤(アロフィセルなど)が欧州や日本で承認されています。
従来の治療では閉鎖が困難だった瘻孔に対して、MSCの抗炎症作用と創傷治癒促進作用が働き、高い閉鎖率を示しています。全身投与による腸管粘膜の炎症制御に関する研究も進んでおり、QOLを著しく低下させるIBDに対する新たな希望となっています。
MSCの社会実装に向けた安全性確保と品質管理の課題
MSCの臨床応用は急速に進展していますが、広く社会実装されるためには解決すべき課題も残されています。安全性と品質の担保は、医療としての信頼性を確立するための最重要事項です。実用化に向けたハードルと対策について解説します。
腫瘍形成性(Tumorigenicity)のリスク評価と長期的安全性
幹細胞治療において常に懸念されるのが、移植細胞の腫瘍化リスクです。MSCはiPS細胞などに比べて造腫瘍性は極めて低いとされていますが、体外での培養過程で染色体異常が蓄積する可能性はゼロではありません。
特に、長期間の培養や過度な継代(細胞分裂)を経た細胞では、形質転換のリスク評価が必須です。
臨床応用にあたっては、核型分析や軟寒天コロニー形成試験などを用いて、腫瘍形成性がないことを厳密に確認するプロセスが求められます。長期的な予後追跡調査(レジストリ構築)も、安全性を社会に示す上で重要になってきます。
ドナー差および細胞集団の不均一性(Heterogeneity)の制御
MSCは「不均一な(Heterogeneous)」細胞集団であることが知られています。ドナーの年齢、性別、健康状態によって細胞の質に差が出る(ドナー差)だけでなく、同じドナーから採取した細胞の中にも機能差が存在します。
この不均一性は、治療効果のばらつきにつながる可能性があります。
そのため、特定のマーカーを用いて高機能な細胞集団のみを選別する技術や、ドナースクリーニングの基準を明確化することが、安定した治療成績を得るための鍵となります。
商用化に向けた大規模培養技術とGCTP/GMP準拠の品質管理
多くの患者さんに治療を届けるためには、高品質な細胞を大量に製造する技術が必要です。研究室レベルの手作業による培養から、バイオリアクター等を用いた自動培養システムへの移行が進んでいます。
この際、GCTP(再生医療等製品の製造管理及び品質管理の基準)やGMPといった厳格な基準に準拠した製造施設(CPF)での管理が求められます。
無菌性の保証、マイコプラズマ否定試験、エンドトキシン試験など、医薬品と同等レベルの品質管理体制を構築することは、コスト面でも大きな課題となっています。
再生医療等安全性確保法に基づく法規制と臨床研究の枠組み
日本においては、「再生医療等の安全性の確保等に関する法律(再生医療等安全性確保法)」により、MSCを用いた治療はリスクに応じた分類(第1種〜第3種)がなされ、規制されています。
- 第1種: 他人の細胞や、培養工程で動物由来成分等を使用したものなど(高リスク)
- 第2種: 本人の細胞を培養して用いるものなど(中リスク)
医療機関がMSC治療を行うには、認定再生医療等委員会での審査と厚生労働省への届出が必要です。この法規制は、患者さんの安全を守る防波堤であると同時に、手続きの複雑さが普及の妨げにならないよう、適切な運用のバランスが模索されています。
まとめ

間葉系幹細胞(MSC)は、その多面的な作用機序と高い安全性から、再生医療の主役として確固たる地位を築きつつあります。
組織修復だけでなく、免疫調節やパラクライン効果による治療戦略は、従来の医療では解決できなかった難治性疾患に対する希望の光です。
細胞ソースの選択、作用メカニズムの深い理解、そして厳格な品質管理に基づく安全性の確保。これらが有機的に結びつくことで、MSC治療はさらに発展するでしょう。
日々更新されるエビデンスを注視し、科学的根拠に基づいた適切な臨床応用を進めていくことが、私たち医療従事者や研究者に求められています。
間葉系幹細胞(MSC)の特性と臨床応用についてよくある質問
の特性と臨床応用についてよくある質問-1-scaled.jpg)
-
Q1. MSCの作用機序の中で、現在最も重要視されているものは何ですか?
- かつては組織への分化能が注目されていましたが、現在は免疫調節能や、液性因子・エクソソームを放出するパラクライン効果が治療効果の主役であると考えられています。これにより、細胞が生着しなくても抗炎症作用や組織修復促進効果が期待できます。
-
Q2. 自家移植と他家移植、これからはどちらが主流になりますか?
- 現在は安全性の高い自家移植が多く行われていますが、製造コストの削減や緊急時の即応性を考慮すると、今後は品質管理された他家移植(同種移植)の製剤化が進むと予想されます。特に臍帯由来MSCなどは免疫原性が低く、他家移植に適しています。
-
Q3. MSC治療における主な副作用やリスクにはどのようなものがありますか?
- 一般的に安全性は高いですが、投与時の肺塞栓(細胞が肺の毛細血管に詰まる)、感染症、アレルギー反応などのリスクがあります。また、長期的には理論上の腫瘍化リスクも考慮し、適切な経過観察が必要です。
-
Q4. 培養上清液(エクソソーム)療法と細胞移植は何が違いますか?
- 細胞移植は、細胞が患部に集まるホーミング効果や、環境に応じた持続的な因子の放出が期待できます。一方、上清液療法は細胞を含まないため、塞栓症や腫瘍化のリスクが低く、扱いやすいですが、効果の持続性やホーミング能力は細胞に劣る可能性があります。
-
Q5. クリニックでMSC治療を行うにはどのような手続きが必要ですか?
- 再生医療等安全性確保法に基づき、提供計画を作成し、認定再生医療等委員会の審査を受けて承認を得た後、厚生労働大臣に届け出る必要があります。細胞の加工を外部委託する場合は、許可を受けた細胞培養加工施設と契約する必要があります。